题目内容
【题目】(1)FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1﹕1﹕1时,实际参加反应的FeS与HNO3的物质的量之比为____________。
(2)在P+CuSO4+H2O→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 mol CuSO4可氧化P的物质的量为____________mol。
(3)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是___________mL。
(4)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:
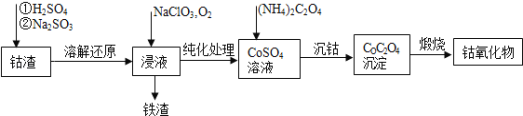
Co(OH)3溶解还原反应的离子方程式为_______________________________,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为______________。
【答案】1:7 1.5 60 2Co(OH)3+4H++SO32-=2Co2++SO42-+5H2O Co3O4.
【解析】
(1)根据电子转移守恒以及原子守恒进行计算;
(2)根据电子转移守恒进行计算;
(3)根据电子转移守恒以及原子守恒进行计算;
(4)Co(OH)3溶解还原反应为Co(OH)3、H+、SO32-的氧化还原反应;根据质量守恒定律计算氧化物的化学式。
(1)设参加反应的FeS为1mol,则溶液中Fe2(SO4)3为1/3 mol,Fe(NO3)3为1/3 mol,反应中Fe元素、S元素化合价升高,N元素化合价降低,设NO2、N2O4、NO的物质的量均为amol,根据电子转移守恒有:1×(3-2)+1×[6-(-2)]=a×(5-4)+a×(5-4)×2+a×(5-2),解得:a=1.5,则NO2、N2O4、NO的物质的量分别为1.5mol、1.5mol、1.5mol,则起氧化剂作用的HNO3为:1.5mol+1.5mol×2+1.5mol=6mol,起酸的作用的硝酸为1/3 mol×3=1mol,参加反应的硝酸为:6mol+1mol=7mol,所以实际参加反应的FeS与HNO3的物质的量之比=1mol:7mol=1:7;
(2)反应中铜元素化合价从+2价降低到+1价,得到1个电子,P元素化合价从0价升高到+5价,失去5个电子,则根据电子得失守恒可知7.5 mol CuSO4可氧化P的物质的量为7.5mol÷5=1.5mol;
(3)NO2、N2O4、NO的混合气体与1.68L O2(标准状况)混合后通入水中,完全生成HNO3,则整个过程中HNO3反应前后没有变化,即Cu失去的电子都被O2得到了,根据得失电子守恒:n(Cu)×2=n(O2)×4,即n(Cu)×2=1.68/22.4 mol×4,解得:n(Cu)=0.15mol,所以溶液中铜离子为0.15mol,根据Cu2+~2OH-可知NaOH为0.15mol×2=0.3 mol,则NaOH溶液的体积0.3mol÷5mol/L=0.06L=60mL;
(4)Co(OH)3溶解还原反应为Co(OH)3、H+、SO32-的氧化还原反应,其离子反应为2Co(OH)3+4H++SO32-=2Co2++SO42-+5H2O;煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),n(CO2)=1.344L÷22.4L/mol=0.06mol,由化学式可知n(Co)=0.06mol×1/2=0.03mol,则氧化物中n(O)=(2.41g-0.03mol×59g/mol)÷16g/mol=0.04mol,则n(Co):n(O)=0.03mol:0.04mol=3:4,所以钴氧化物的化学式为Co3O4。

 阅读快车系列答案
阅读快车系列答案