题目内容
【题目】钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
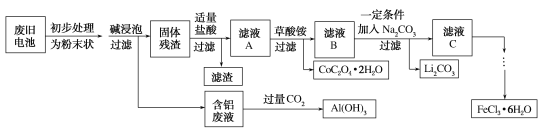
已知:还原性:Cl>Co2+;
回答下列问题:
(1)废旧电池初步处理为粉末状的目的是___________。
(2)从含铝废液得到Al(OH)3的离子方程式为________。
(3)滤液A中的溶质除HCl、LiCl外还有FeCl3、CoCl2。写出LiCoO2和盐酸反应的化学方程式_______。
(4)滤渣的主要成分为______(填化学式)。
(5)已知Li2CO3的溶度积常数Ksp=8.64×104,将浓度为0.02mol·L1的Li2SO4和浓度为0.02 mol·L1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为________ mol·L1。
(6)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是________。
【答案】增大接触面积,加快反应速率,提高浸出率 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 2LiCoO2+8HCl=2CoCl2+Cl2↑+4H2O+2LiCl C 0.02 加入适量盐酸(或通入适量氯化氢气体)
【解析】
废旧钴酸锂镍离子电池主要含有Fe、Al、碳的单质和LiCoO2,初步处理,加碱浸泡,铝和碱液反应生成偏铝酸盐和氢气,固体残渣为:Fe、C的单质和LiCoO2,加盐酸Fe+2H+=Fe2++H2↑,2LiCoO2+8H++2Cl-=2Li++2Co2++Cl2↑+4H2O,沉淀为C,滤液A为Fe3+、Li+、Co3+、Cl-,加入草酸铵,过滤沉淀为CoC2O42H2O,滤液B为:Fe3+、Li+、Cl-,加入碳酸钠,发生的离子反应为2Li++CO32-=Li2CO3↓,滤液C为Fe3+、Cl-,加入氧化剂防止铁离子被还原得氯化铁溶液,据此分析解答。
(1)废旧电池初步处理为粉末状的目的是:增大接触面积,加快反应速率,提高浸出率;
(2)从含铝废液得到Al(OH)3的离子反应方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)LiCoO2中Li为+1价,Co为+3价,具有氧化性,HCl中-1价的氯具有还原性,向固体残渣中加入盐酸时,Co(+3→+2),Cl(-1→0),最小公倍数为1,因Cl2为双原子分子,所以LiCoO2前系数为2,根据原子守恒,未知物为水,所以反应为:2LiCoO2+8HCl=2LiCl+2CoCl2+Cl2↑+4H2O;
(4)上述分析可知,滤渣的主要成分为C;
(5)将浓度为0.02molL-1的Li2SO4和浓度为0.02molL-1的Na2CO3溶液等体积混合,计算得到溶液中c(Li+)=0.02mol/L,c(CO32-)=0.01mol/L,计算浓度商Qc=c2(Li+)×c(CO32-)=4×10-6<Ksp=8.64×10-4,无沉淀生成,则此时溶液中Li+浓度为0.02mol/L;
(6)氯化铁溶液中氯化铁水解生成氢氧化铁和氯化氢,氯化氢是易挥发的物质,加热会促进水解生成氢氧化铁,从FeCl3溶液得到FeCl36H2O固体的操作关键是抑制氯化铁水解,加入适量盐酸(或通入适量氯化氢气体)。