题目内容
甲醇可通过将煤气化过程中生成的CO和H2在一定条件下,发生如下反应制得:CO(g)+2H2(g) CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:

(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)= ,CO的转化率为 。
(2)该反应的平衡常数表达式为 ,温度升高,平衡常数 (填“增大”、“减小”或“不变”)。
(3)若在一体积可变的密闭容器中充入1 mol CO、2 mol H2和1 mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则加入各物质后该反应向 (填“正”、“逆”)反应方向移动,理由是 。
(1)0.15 mol·L-1·min-1 75%
(2)K= 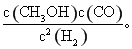 减小
减小
(3)正 反应前后气体总质量不变,同温、同压下,达到平衡时,气体密度增大,即气体体积减小,平衡正移
【解析】(1)根据图一可知,反应开始到达到平衡的过程中CO的浓度变化为0.75 mol·L-1,所以CO的反应速率为v(CO)=0.75 mol·L-1/10 min=0.075 mol·L-1·min-1,根据反应速率之比等于化学计量数之比可知,v(H2)=2v(CO)=2×0.075 mol·L-1·min-1=0.15 mol·L-1·min-1,CO的转化率为0.75 mol·L-1/1.00 mol·L-1×100%=75%。
(2)该反应的平衡常数表达式为K=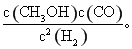 根据图二可知,反应物的能量比生成物的能量高,所以正反应为放热反应,升高温度,平衡常数减小。
根据图二可知,反应物的能量比生成物的能量高,所以正反应为放热反应,升高温度,平衡常数减小。
(3)因为反应物和生成物都是气体,反应过程中质量不变,气体的密度ρ=m/V。密度增大,说明容器的体积减小,因为反应在恒压的条件下进行,容器体积减小,说明反应后气体的物质的量减少,因为正反应方向是气体物质的量减少的反应,所以平衡向正反应方向移动。

 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案