题目内容
已知黑火药反应的方程式为:2KNO3+S+3C====K2S+N2↑+3CO2↑求此反应中被 1.0 mol KNO3氧化的碳的质量是多少克?
1.0 mol KNO3氧化的碳的质量是15 g。
本题由给出的化学反应方程式主要考查氧化还原反应的概念及有关计算。
首先分析给出的化学反应方程式,化合价降低的反应物在反应中作氧化剂,它们是KNO3和S,即N和S两种元素反应前后化合价由高变低。不少学生考虑不全,误认为氧化剂只有KNO3或只有S。本题是两种元素N和S氧化一种元素C。根据得失电子关系,C的化合价升高4价,即1 mol 碳单质在反应中失去4 mol e-,3 mol碳单质共失去 12 mol e-,而2 mol KNO3共得到 10 mol e- ,1 mol硫单质只得到2 mol e-。由反应方程式分析可知,被2 mol KNO3氧化的碳占总物质的量的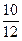 ,即
,即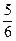 ,而反应中总共被氧化的碳的物质的量为3 mol,所以被 2 mol KNO3氧化的碳的物质的量=
,而反应中总共被氧化的碳的物质的量为3 mol,所以被 2 mol KNO3氧化的碳的物质的量=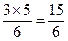 mol="2.5" mol,故被 1.0 mol KNO3氧化的碳的物质的量为
mol="2.5" mol,故被 1.0 mol KNO3氧化的碳的物质的量为 mol 。
mol 。
2KNO3 + S + 3C====K2S+N2↑+3CO2↑
2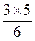
1 mol n(C)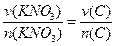
n(C)=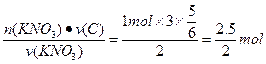 ="1.25" mol
="1.25" mol
m(C)=n(C)·M(C)="1.25" mol×12 g·mol-1="15" g
首先分析给出的化学反应方程式,化合价降低的反应物在反应中作氧化剂,它们是KNO3和S,即N和S两种元素反应前后化合价由高变低。不少学生考虑不全,误认为氧化剂只有KNO3或只有S。本题是两种元素N和S氧化一种元素C。根据得失电子关系,C的化合价升高4价,即1 mol 碳单质在反应中失去4 mol e-,3 mol碳单质共失去 12 mol e-,而2 mol KNO3共得到 10 mol e- ,1 mol硫单质只得到2 mol e-。由反应方程式分析可知,被2 mol KNO3氧化的碳占总物质的量的
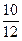 ,即
,即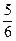 ,而反应中总共被氧化的碳的物质的量为3 mol,所以被 2 mol KNO3氧化的碳的物质的量=
,而反应中总共被氧化的碳的物质的量为3 mol,所以被 2 mol KNO3氧化的碳的物质的量=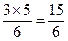 mol="2.5" mol,故被 1.0 mol KNO3氧化的碳的物质的量为
mol="2.5" mol,故被 1.0 mol KNO3氧化的碳的物质的量为 mol 。
mol 。2KNO3 + S + 3C====K2S+N2↑+3CO2↑
2
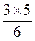
1 mol n(C)
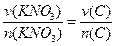
n(C)=
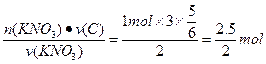 ="1.25" mol
="1.25" molm(C)=n(C)·M(C)="1.25" mol×12 g·mol-1="15" g

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 X+2Y+4Z,生成物都是气体,测得由生成物组成的混合气体对H2的相对密度为11.43,则W的相对分子质量是( )
X+2Y+4Z,生成物都是气体,测得由生成物组成的混合气体对H2的相对密度为11.43,则W的相对分子质量是( ) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O H2↑+Cl2↑
H2↑+Cl2↑