题目内容
一氧化碳和二氧化碳的混合气体18 g完全燃烧后所得气体的体积在标准状况下为11.2 L。求原混合气体中一氧化碳和二氧化碳的质量各是多少?体积比是多少?
m(CO)="7" g m(CO2)="11" g
V(CO)∶V(CO2)=1∶1
V(CO)∶V(CO2)=1∶1
设原混合气体中CO的物质的量为x,CO2的物质的量为y。
则有:28 g·mol-1x+44 g·mol-1y="18 " ①
根据:2CO+O2====2CO2,知完全燃烧后气体的物质的量不变,即体积不变,则有x+y=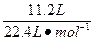 ②
②
联立①②得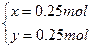
故m(CO)="28" g·mol-1×0.25 mol="7" g
m(CO2)="44" g·mol-1×0.25 mol="11" g
V(CO)∶V(CO2)=n(CO)∶n(CO2)=0.25∶0.25=1∶1。
则有:28 g·mol-1x+44 g·mol-1y="18 " ①
根据:2CO+O2====2CO2,知完全燃烧后气体的物质的量不变,即体积不变,则有x+y=
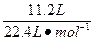 ②
②联立①②得
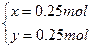
故m(CO)="28" g·mol-1×0.25 mol="7" g
m(CO2)="44" g·mol-1×0.25 mol="11" g
V(CO)∶V(CO2)=n(CO)∶n(CO2)=0.25∶0.25=1∶1。

练习册系列答案
相关题目
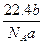 L
L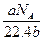 L
L L
L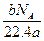 L
L