题目内容
25 ℃时,钠的三种化合物的溶解度如下表:
该温度时,用NaOH、水、CaCO3和盐酸为原料制备并从溶液中结晶出33 g纯NaHCO3。
(1)若用水100 g制取时需NaOH多少克?
(2)若用NaOH(s)17.86 g,则需用水_________克。
| 化合物 | NaHCO3 | Na2CO3 | NaOH |
| 溶解度/g | 9 | 33 | 110 |
(1)若用水100 g制取时需NaOH多少克?
(2)若用NaOH(s)17.86 g,则需用水_________克。
(1)20 g (2)50 g
本题应紧紧抓住溶解度的概念进行剖析,要在溶液中制取33 g的NaHCO3,不能用加热蒸干溶剂的方法得到NaHCO3,因为NaHCO3受热易分解,只能用结晶析出法得到NaHCO3晶体。本题为综合应用类习题,中等难度。
(1)25 ℃时100 g水中溶解NaHCO3 9 g,要析出33 g,则生成42 g NaHCO3,由反应NaOH+CO2====NaHCO3可知需NaOH 20 g。
(2)NaOH+CO2====NaHCO3
40 g 84 g
17.86 g m(NaHCO3)
17.86 g∶m(NaHCO3)="40" g∶84 g
所以m(NaHCO3)="37.5" g
要析出33 g NaHCO3,则溶于水的NaHCO3应为37.5 g-33 g="4.5" g
溶解4.5 g需水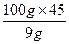 g="50" g
g="50" g
(1)25 ℃时100 g水中溶解NaHCO3 9 g,要析出33 g,则生成42 g NaHCO3,由反应NaOH+CO2====NaHCO3可知需NaOH 20 g。
(2)NaOH+CO2====NaHCO3
40 g 84 g
17.86 g m(NaHCO3)
17.86 g∶m(NaHCO3)="40" g∶84 g
所以m(NaHCO3)="37.5" g
要析出33 g NaHCO3,则溶于水的NaHCO3应为37.5 g-33 g="4.5" g
溶解4.5 g需水
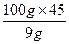 g="50" g
g="50" g
练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目