题目内容
【题目】环境问题正引起全社会的关注,用NH3催化还原NOx可以消除氮氧化物的污染,对构建生态文明有着极为重要的意义。
(1)已知N2(g)+3H2(g) ![]() 2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图。
2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图。
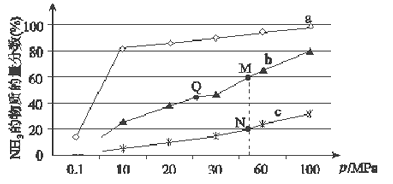
①曲线a对应的温度是_________℃。
②上图中M、N、Q三点对应的平衡常数K(M)、K(N)、K(Q)的大小关系是_________________。
如果N点时c(NH3)=0.2 mol·L-1,则N点的化学平衡常数K=______(保留2位小数)。
(2)用NH3催化还原NO时包含以下反应:
反应I:4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(l) △H1
5N2(g)+6H2O(l) △H1
反应II: 2NO(g) +O2(g) ![]() 2NO 2(g) △H2
2NO 2(g) △H2
反应III:4NH3(g)+6NO2 (g) ![]() 5N2(g)+3O2(g) + 6H2O(l) △H3
5N2(g)+3O2(g) + 6H2O(l) △H3
△H1=________(用含△H2、△H3的式子表示)。
(3)SNCR-SCR是一种新兴的烟气脱硝技术(除去烟气中的NOx)。其流程如下:

该方法中反应的热化学方程式为:
4NH3(g)+4NO (g) + O2 (g)![]() 4N2(g)+ 6H2O(g) △H=-1646 kJ·mol -1
4N2(g)+ 6H2O(g) △H=-1646 kJ·mol -1
①在一定温度下,在密闭恒压的容器中,能表示上述反应达到化学平衡状态的是_______(填字母)。
a.4v逆(N2)=v正(O2)
b.混合气体的密度保持不变
c.c(N2):c(H2O):c(NH3)=4:6:4
d.单位时间内断裂12molN-H键的同时断裂12molO-H键
②如下图所示,反应温度会直接影响SNCR技术的脱硝效率。
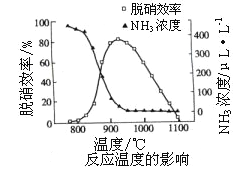
SNCR技术脱硝的最佳温度选择925℃的理由是_____________________;SNCR与SCR技术相比,SNCR技术的反应温度较高,其原因是________________;但当烟气温度高于1000℃时,SNCR脱硝效率明显降低,其原因主要是_____________________。(用平衡移动原理解释)
【答案】 200℃ K(M)=K(Q)>K(N) 0.93L2/mol2 3△H2+△H3 bd 925℃时脱硝效率高,残留氨浓度较小 反应的活化能较大,没有使用催化剂 因为脱硝反应的正反应是放热反应,温度过高使平衡逆向移动。
【解析】(1)①合成氨的反应为放热反应,反应温度越高,越不利于反应正向进行,曲线a的氨气的物质的量分数最高,其反应温度对应相对最低,所以a曲线对应温度为200°C;故答案为:200℃;
②平衡常数与温度有关,与其他条件无关,温度相同时平衡常数相同,反应是放热反应,温度越高平衡常数越小,则M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N),N点时c(NH3)=0.2molL-1,氨气体积分数为20%,则:
N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
起始浓度(mol/L): x 3x 0
变化浓度(mol/L): 0.1 0.3 0.2
平衡浓度(mol/L):x-0.1 3x-0.3 0.2
所以![]() =20%,解得x=0.3,平衡常数K=
=20%,解得x=0.3,平衡常数K=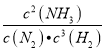 =
=![]() ≈0.93,故答案为:K(M)=K(Q)>K(N);0.93;
≈0.93,故答案为:K(M)=K(Q)>K(N);0.93;
(2)反应II: 2NO(g) +O2(g) ![]() 2NO 2(g) △H2,反应III:4NH3(g)+6NO2 (g)
2NO 2(g) △H2,反应III:4NH3(g)+6NO2 (g) ![]() 5N2(g)+3O2(g) + 6H2O(l)△H3,根据盖斯定律,将反应II×3+反应III得:4NH3(g)+6NO(g)
5N2(g)+3O2(g) + 6H2O(l)△H3,根据盖斯定律,将反应II×3+反应III得:4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(l) △H1= 3△H2+△H3,故答案为:3△H2+△H3;
5N2(g)+6H2O(l) △H1= 3△H2+△H3,故答案为:3△H2+△H3;
(3)①a. v逆(N2)=4v正(O2)表示正逆反应速率相等,因此4v逆(N2)=v正(O2),表示正逆反应速率不相等,说明反应未达到化学平衡状态,错误;b.该反应属于气体的体积变化的反应,当混合气体的密度保持不变,能够说明反应达到化学平衡状态,正确;c.c(N2):c(H2O):c(NH3)=4:6:4,不能说明正逆反应速率是否相等,因此不能判断反应是否达到化学平衡状态,错误;d.单位时间内断裂12molN-H键的同时断裂12molO-H键,表示正逆反应速率相等,能够说明反应达到化学平衡状态,正确;故选bd;
②根据图像,925℃时脱硝效率高,残留氨浓度较小,SNCR技术脱硝的最佳温度应该选择925℃,SNCR与SCR技术相比,反应的活化能较大,没有使用催化剂,因此SNCR技术的反应温度较高;因为脱硝反应的正反应是放热反应,温度过高使平衡逆向移动,因此当烟气温度高于1000℃时,SNCR脱硝效率明显降低,故答案为:925℃时脱硝效率高,残留氨浓度较小;反应的活化能较大,没有使用催化剂;因为脱硝反应的正反应是放热反应,温度过高使平衡逆向移动。

 智慧小复习系列答案
智慧小复习系列答案