题目内容
【题目】乙酸是重要的化工原料,在生活、生产中被广泛应用。
(1)写出乙酸在水溶液中的电离方程式_______________________。若某温度下,CH3COOH(aq)与NaOH(aq)反应的焓变△H= - 46.8kJ·mol-1 ,HCl(aq)与NaOH(aq)反应的焓变△H= - 55.6 kJ·mol-1,则CH3COOH在水中电离的焓变△H=_________kJ·mol-1。
(2)已知常温下CH3COOH的电离常数K=1.6×10-5,该温度下,1 mol·L-1CH3COONa溶液pH约为________(已知lg2=0.3)。向pH=2的CH3COOH溶液中加入pH=2的稀硫酸溶液,保持溶液温度不变,溶液的pH将________________填“变大”或“变小”或“不变”)。
(3)常温下,向10 mL 0.1 mol·L-1的CH3COOH溶液中逐滴滴入0.1 mol·L-1的ROH溶液,所得溶液pH及导电性变化如图。下列分析正确的是_______。

A.b点导电能力最强,说明ROH为强碱
B.b点溶液pH=5,此时酸碱恰好中和
C.c点溶液存在c(R+)>c(CH3COO-)、c(OH-)>c(H+)
D.b~c任意点溶液均有c(H+)·c(OH-)=KW=1.0×10-14
(4)近年来用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,具有明显经济优势。其合成的基本反应如下:![]()
①在恒温恒容容器中投入一定量的乙烯和足量的乙酸,下列分析正确的是________。
A.当乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol,说明反应已达到化学平衡
B.当体系中乙烯的百分含量保持不变,说明反应已达到化学平衡
C.达到化学平衡后再通入少量乙烯,再次达到化学平衡时,乙烯的浓度与原平衡相等
D.该反应的平衡常数表达式为K=![]()
②乙烯与乙酸等物质的量投料条件下,某研究小组在不同压强下进行了在相同时间点乙酸乙酯的产率随温度的变化的测定实验,实验结果如图所示。回答下列问题:
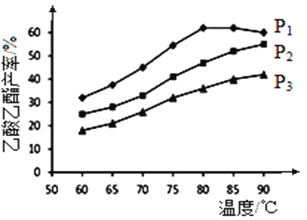
温度在60~80℃范围内,乙烯与乙酸反应速率由大到小的顺序是__________________[用![]() (P1)、
(P1)、![]() (P2)、
(P2)、![]() (P3)分别表示不同压强下的反应速率]。在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是___________________________。根据测定实验结果分析,较适宜的生产条件是_________________(填出合适的压强和温度)。为提高乙酸乙酯的合成速率和产率,可以采取的措施有___________________(任写出一条)。
(P3)分别表示不同压强下的反应速率]。在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是___________________________。根据测定实验结果分析,较适宜的生产条件是_________________(填出合适的压强和温度)。为提高乙酸乙酯的合成速率和产率,可以采取的措施有___________________(任写出一条)。
【答案】 CH3COOH![]() CH3COO—+ H+ +8.8 9.4 不变 C D B C
CH3COO—+ H+ +8.8 9.4 不变 C D B C ![]() (P1)﹥
(P1)﹥![]() (P2)﹥
(P2)﹥![]() (P3) 由图像可知,P1 MPa 、80℃时反应已达平衡且正反应放热,故压强不变升高温度平衡逆向移动产率下降 P1 MPa、80℃ 通入乙烯气体或增大压强
(P3) 由图像可知,P1 MPa 、80℃时反应已达平衡且正反应放热,故压强不变升高温度平衡逆向移动产率下降 P1 MPa、80℃ 通入乙烯气体或增大压强
【解析】(1)乙酸是一元弱酸,在水溶液中的电离方程式为CH3COOH![]() CH3COO-+ H+。若某温度下,CH3COOH(aq)与NaOH(aq)反应的焓变△H= - 46.8kJ·mol-1 ,HCl(aq)与NaOH(aq)反应的焓变△H= - 55.6 kJ·mol-1,则CH3COOH在水中电离的焓变△H=- 46.8kJ·mol-1 -( - 55.6 kJ·mol-1)=8.8kJ·mol-1。(2)已知常温下CH3COOH的电离常数K=1.6×10-5,该温度下醋酸钠的水解常数为10-14/.6×10-5,因此1 mol·L-1CH3COONa溶液中氢氧根离子浓度为
CH3COO-+ H+。若某温度下,CH3COOH(aq)与NaOH(aq)反应的焓变△H= - 46.8kJ·mol-1 ,HCl(aq)与NaOH(aq)反应的焓变△H= - 55.6 kJ·mol-1,则CH3COOH在水中电离的焓变△H=- 46.8kJ·mol-1 -( - 55.6 kJ·mol-1)=8.8kJ·mol-1。(2)已知常温下CH3COOH的电离常数K=1.6×10-5,该温度下醋酸钠的水解常数为10-14/.6×10-5,因此1 mol·L-1CH3COONa溶液中氢氧根离子浓度为![]() ,所以氢离子浓度是4×10-10mol/L,则溶液的pH约为9.4。向pH=2的CH3COOH溶液中加入pH=2的稀硫酸溶液,保持溶液温度不变,氢离子浓度不变,则溶液的pH不变。(3)A、b点恰好反应,生成盐,所以导电能力最强,但不能说明ROH为强碱,A错误;B、b点消耗ROH是10mL,所以酸碱恰好中和,pH=7,B错误;C.c点溶液中溶质是等浓度的盐和ROH的混合溶液,溶液显碱性,因此存在c(R+)>c(CH3COO-)、c(OH-)>c(H+),C正确;D.水的离子积常数是定值,因此b~c任意点溶液均有c(H+)·c(OH-)=KW=1.0×10-14,D正确,答案选CD。(4)①A.当乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol,均表示正反应速率,不能说明反应达到平衡状态,A错误;B.当体系中乙烯的百分含量保持不变,说明反应已达到化学平衡,B正确;C.反应中只有乙烯是气体,温度不变,平衡常数不变,所以达到化学平衡后再通入少量乙烯,再次达到化学平衡时,乙烯的浓度与原平衡相等,C正确;D.反应中只有乙烯是气体,该反应的平衡常数表达式为K=c(CH2=CH2),D错误,答案选BC。②温度一定压强增大平衡正向进行,反应速率增大,图象分析可知P1>P2>P3,则温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小顺序是v(P1)>v(P2)>v(P3);在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是:由图象可知,P1 MPa、80℃时反应已达平衡且正反应放热,故压强不变升高温度平衡逆向移动产率下降;选择适宜条件使得乙酸乙酯产率达到最大,图象中乙酸乙酯产率最大的条件是:P1 MPa、80℃。为提高乙酸乙酯的合成速率和产率,应该改变的条件加快反应速率且平衡正向进行,可以增大反应物浓度或增大压强等。
,所以氢离子浓度是4×10-10mol/L,则溶液的pH约为9.4。向pH=2的CH3COOH溶液中加入pH=2的稀硫酸溶液,保持溶液温度不变,氢离子浓度不变,则溶液的pH不变。(3)A、b点恰好反应,生成盐,所以导电能力最强,但不能说明ROH为强碱,A错误;B、b点消耗ROH是10mL,所以酸碱恰好中和,pH=7,B错误;C.c点溶液中溶质是等浓度的盐和ROH的混合溶液,溶液显碱性,因此存在c(R+)>c(CH3COO-)、c(OH-)>c(H+),C正确;D.水的离子积常数是定值,因此b~c任意点溶液均有c(H+)·c(OH-)=KW=1.0×10-14,D正确,答案选CD。(4)①A.当乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol,均表示正反应速率,不能说明反应达到平衡状态,A错误;B.当体系中乙烯的百分含量保持不变,说明反应已达到化学平衡,B正确;C.反应中只有乙烯是气体,温度不变,平衡常数不变,所以达到化学平衡后再通入少量乙烯,再次达到化学平衡时,乙烯的浓度与原平衡相等,C正确;D.反应中只有乙烯是气体,该反应的平衡常数表达式为K=c(CH2=CH2),D错误,答案选BC。②温度一定压强增大平衡正向进行,反应速率增大,图象分析可知P1>P2>P3,则温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小顺序是v(P1)>v(P2)>v(P3);在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是:由图象可知,P1 MPa、80℃时反应已达平衡且正反应放热,故压强不变升高温度平衡逆向移动产率下降;选择适宜条件使得乙酸乙酯产率达到最大,图象中乙酸乙酯产率最大的条件是:P1 MPa、80℃。为提高乙酸乙酯的合成速率和产率,应该改变的条件加快反应速率且平衡正向进行,可以增大反应物浓度或增大压强等。

 阅读快车系列答案
阅读快车系列答案【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有关说法正确的是
A. 反应在0~3 s内的平均速率v(NO2)=0.24 mol·L-1·s-1
B. 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol·L-1,则反应的ΔH>0
C. 在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,达到平衡时,N2O5的转化率大于20%
D. 在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反应达到平衡时,压强为起始时的0.88倍