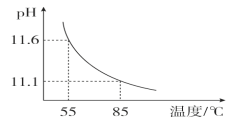
题目内容
【题目】下列根据实验操作及现象推出的结论正确的是
| 实验操作 | 实验现象 | 实验结论 |
A. | 向某溶液中滴加少量氯水,再滴加淀粉溶液 | 溶液变为蓝色 | 则原溶液中一定含 |
B. | 向某盐溶液中滴加浓盐酸,将产生的气体通入品红溶液中 | 品红溶液褪色 | 该盐一定是亚硫酸盐或亚硫酸氢盐 |
C. | 将浓盐酸与石灰石混合,产生的气体通入 | 出现白色沉淀 | C的非金属性比Si强 |
D. | 加热涂有石蜡油的碎瓷片,将生成的气体通入酸性 |
| 石蜡油分解产生不饱和烃 |
A.AB.BC.CD.D
【答案】D
【解析】
A.若原溶液为含![]() 的溶液,也会出现同样现象,故A错误;
的溶液,也会出现同样现象,故A错误;
B.若该盐溶液为NaClO或![]() 溶液,也会出现该现象,故B错误;
溶液,也会出现该现象,故B错误;
C.HCl易挥发,挥发出的HCl也可与![]() 溶液反应生成
溶液反应生成![]() 沉淀,故C错误;
沉淀,故C错误;
D.石蜡油为多碳烃类物质,受热分解产生的气体可使![]() 溶液褪色,说明有不饱和烃生成,故D正确;
溶液褪色,说明有不饱和烃生成,故D正确;
故答案为D。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】Ⅰ.按要求回答下列问题:
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)![]() NH2COONH4(s)△H1
NH2COONH4(s)△H1
反应Ⅱ:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g)△H2=+72.49kJ/mol
CO(NH2)2(s)+H2O(g)△H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)△H3=-86.98kJ/mol
CO(NH2)2(s)+H2O(g)△H3=-86.98kJ/mol
①反应Ⅰ的△H1=__。
②一定温度下,在体积固定的密闭容器中按n(NH3):n(CO2)=2:1进行反应Ⅰ,下列能说明反应Ⅰ达到了平衡状态的是__(填序号)。
A.容器内气体总压强不再变化
B.NH3与CO2的转化率相等
C.容器内混合气体的密度不再变化
(2)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=__。
②该反应为__(填“吸热”或“放热”)反应。
③某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为__℃。
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol·L-1,c(H2)为1.5mol·L-1,c(CO)为1mol·L-1,c(H2O)为3mol·L-1,此时反应向__(填“正向”或“逆向”)进行。
(3)工业上从废铅蓄电池废液回收铅的过程中,常用纯碱溶液与处理后的铅膏(主要含PbSO4)发生反应:PbSO4(s)+CO![]() (aq)
(aq)![]() PbCO3(s)+SO
PbCO3(s)+SO![]() ( aq)。
( aq)。
已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K=__。
Ⅱ.N2H4—O2燃料电池是一种高效低污染的新型电池,其装置如图所示:
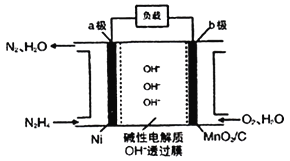
(1)N2H4的电子式为__;
(2)a极的电极反应方程式为___。