题目内容
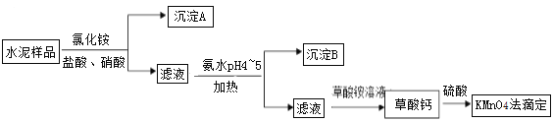
【题目】港珠澳大桥水泥的使用量约198万吨。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
下列叙述正确的是
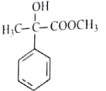
A. 水泥、玻璃、陶瓷为传统的硅酸盐材料,三者的原料都主要为SiO2
B. 沉淀A主要成分为SiO2,沉淀B为Fe(OH)3、Al(OH)3
C. 为了加快溶解速率,使用盐酸代替硫酸处理草酸钙
D. 草酸钙易溶于水
【答案】B
【解析】
A.水泥、玻璃、陶瓷均为硅酸盐工业产品,所以主要成分是硅酸盐,三者的原料不同,三者的原料并非都主要为SiO2,例如:陶瓷的主要原料有黏土等,水泥的主要原料有石灰石和黏土(铝硅酸盐),故A错误;
B.水泥样品的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物,加入氯化铵、盐酸和硝酸,由于二氧化硅与酸不反应,则得到的沉淀A为SiO2,滤液中含有Ca2+、Fe3+、Al3+、Mg2+等离子,加入氨水调节pH到4~5之间,可生成Al(OH)3、Fe(OH)3沉淀,则沉淀B为Fe(OH)3、Al(OH)3,故B正确;
C.使用盐酸代替硫酸处理草酸钙,在溶液中剩余的盐酸也能被高锰酸钾氧化,从而干扰草酸的测定,进而使测得的钙的含量产生误差,故C错误;
D.草酸钙是难溶于水的白色固体,故D错误;
本题答案为B。

【题目】已知Fe3+和I-在水溶液中的反应为2I-+2Fe3+![]() I2+2Fe2+。某温度下该反应的正反应速率和I-、Fe3+浓度的关系为v=kcm(I-)·cn(Fe3+)(k为常数)。
I2+2Fe2+。某温度下该反应的正反应速率和I-、Fe3+浓度的关系为v=kcm(I-)·cn(Fe3+)(k为常数)。
c(I-)/mol·L-1 | c(Fe3+)/mol·L-1 | v/mol·L-1·s-1 | |
① | 0.20 | 0.80 | 0.032k |
② | 0.60 | 0.40 | 0.144k |
③ | 0.80 | 0.20 | 0.128k |
由此推知,有关Fe3+、I-的浓度对反应速率影响的判断正确的是 ( )
A. Fe3+浓度对正反应速率的影响程度大于I-浓度的影响程度
B. Fe3+浓度对正反应速率的影响程度小于I-浓度的影响程度
C. Fe3+浓度对正反应速率的影响程度等于I-浓度的影响程度
D. 无法比较