题目内容
钠、镁、铁、铜及其化合物在科研和生产生活中有广泛的应用。
(1)Mg—H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,结构如图所示。电池工作时,正极的电极反应式 。常温下,用该电池电解200mL的饱和硫酸铜溶液(电极为惰性电极),反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);当消耗24mg金属Mg,电解后溶液的pH= (不考虑溶液的体积变化)。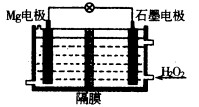
(2)利用电解法在铁制品上镀铜可以防止铁被腐蚀,以下说法正确的是 。
a.电镀时,铜和石墨都可以做阳极,可溶性铜盐作电解质溶液
b.电镀过程中,温度升高,电解反应速率加快
c.电镀过程中,电能全部转化为化学能
d.电镀过程中,铜离子向阴极移动,发生还原反应
(3)NaHS可作为沉淀剂除去溶液中的Cu2+。常温下,NaHS溶液显碱性,原因是 (用离子方程式和必要的文字说明)。向含有Cu2+的废水中加入少量NaHS固体,废水溶液的pH (填“增大”“减小”或“不变”)。
(1)H2O2+2e—=2OH—;向右;2;(2)ad;(3)HS—+H2O H2S+OH—HS—
H2S+OH—HS— H++S2—水解程度大于电离程度,溶液显碱性;减小。
H++S2—水解程度大于电离程度,溶液显碱性;减小。
解析试题分析:(1)本题考查原电池原理的应用、新型化学电源、电解原理的应用。由题给装置图分析Mg—H2O2电池中,镁作负极,发生氧化反应,H2O2在石墨电极上发生还原反应,作正极,电极反应式为H2O2+2e—=2OH—;常温下,用该电池电解200mL的饱和硫酸铜溶液(电极为惰性电极),阳极反应为:2H2O - 4e-== O2↑ + 4H+,反应时溶液中水的电离平衡向右移动;当消耗24mg金属Mg,转移的电子为0.002mol,根据电子守恒结合阳极电极反应式知,产生的氢离子物质的量为0.002mol,氢离子浓度为0.01mol,电解后溶液的pH= 2;(2)考查电解原理的应用、电镀铜;a.电镀时,铜和石墨都可以做阳极,可溶性铜盐作电解质溶液,正确;b.电镀过程中,电解反应速率只与电流强度有关,错误;c.电镀过程中,电能不可能全部转化为化学能,错误;d.电镀过程中,铜离子向阴极移动,发生还原反应,正确,选ad;(3)NaHS为弱酸的酸式盐,常温下,NaHS溶液存在HS—的电离平衡:HS— H++S2—及水解平衡:HS—+H2O
H++S2—及水解平衡:HS—+H2O H2S+OH—,溶液显碱性的原因是HS—的电离程度小于HS—的水解程度;向含有Cu2+的废水中加入少量NaHS固体,Cu2+与S2—反应生成硫化铜沉淀,硫离子浓度减小,HS—的电离平衡:HS—
H2S+OH—,溶液显碱性的原因是HS—的电离程度小于HS—的水解程度;向含有Cu2+的废水中加入少量NaHS固体,Cu2+与S2—反应生成硫化铜沉淀,硫离子浓度减小,HS—的电离平衡:HS— H++S2—向右移动,氢离子浓度增大,废水溶液的pH减小。
H++S2—向右移动,氢离子浓度增大,废水溶液的pH减小。
考点:考查原电池原理和电解原理的应用、弱电解质的电离及盐类水解平衡的应用。

 智能训练练测考系列答案
智能训练练测考系列答案(14分) CuCl是有机合成的重要催化剂,并用于颜料、防腐等工业。工业上由废铜料(含Fe、Al及其化合物、SiO2杂质),生产CuCl的工艺流程如下:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 5.6 | 6.7 |
| Al(OH)3 | 3.8 | 4.7 |
已知:CuCl溶于NaCl的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释后可生成CuCl沉淀。
(1)煅烧的主要目的是: 。
(2)操作Ⅰ为调节溶液的PH值,范围为 ,加入的物质X可以是( )
A、CuO B、Cu(OH)2 C、NaOH 溶液 D、CaCO3
(3)滤渣Ⅱ的主要成分是 。
(4)往滤液Ⅱ中加入食盐并通入SO2可生成CuCl2-,请写出反应的离子方程式: 。
(5)在反应Ⅰ中,温度控制在70~80℃并使用浓NaCl溶液,主要目的是: 。
(6)常温下,已知CuOH的KSP为1.0×10-14,则Cu++H2O
 CuOH + H+的平衡常数为: 。
CuOH + H+的平衡常数为: 。 
 I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度