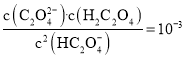题目内容
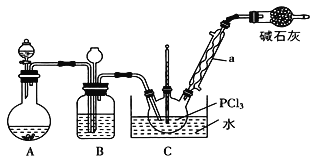
【题目】三氯氧磷(POCl3)是重要的基础化工原料,广泛用于制药、染化、塑胶助剂等行业。某兴趣小组模拟PCl3直接氧化法制备POCl3,实验装置设计如下:
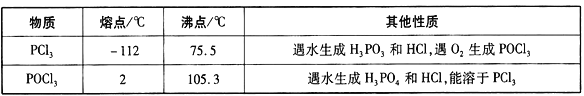
有关物质的部分性质如下表:
回答下列问题:
(1)仪器a的名称是_____________。装置A中发生反应的化学方程式为_______。
(2)装置C中制备POCl3的化学方程式为________________________________。
(3)C装置控制反应在60~65℃进行,其主要目的是_______________________。
(4)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
I.取xg产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至溶液显酸性;
II.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀;
III.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
IV.加入指示剂,用c mol·L-1 NH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是(填序号)________,滴定终点的现象为_____________。
a.酚酞 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②Cl元素的质量分数为(列出算式)________________。
③若取消步骤III,会使步骤IV中增加一个化学反应,该反应的离子方程式为________;该反应使测定结果________(填“偏大”“偏小”或“不变”)。
【答案】冷凝管 2Na2O2+2H2O=4NaOH+O2↑或2H2O![]() =2H2O+O2↑ 2PCl3+O2=2POCl3 加快反应速率,同时防止PCl3气化,逸出损失 b 当加入最后一滴NH4SCN溶液,溶液刚好变为红色,且红色半分钟内不褪色
=2H2O+O2↑ 2PCl3+O2=2POCl3 加快反应速率,同时防止PCl3气化,逸出损失 b 当加入最后一滴NH4SCN溶液,溶液刚好变为红色,且红色半分钟内不褪色 ![]() AgCl(s)+SCN-(aq)
AgCl(s)+SCN-(aq)![]() AgSCN(s)+Cl-(aq) 偏小
AgSCN(s)+Cl-(aq) 偏小
【解析】
根据实验目的及装置图中反应物的状态,分析装置的名称及装置中的相关反应;根据滴定实验原理及相关数据计算样品中元素的含量,并进行误差分析。
(1)根据装置图知,仪器a的名称是冷凝管;根据实验原理及装置中反应物状态分析知,装置A为用固体和液体制备氧气的装置,可以是过氧化钠与水反应,也可能是双氧水在二氧化锰催化下分解,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑或2H2O![]() =2H2O+O2↑,故答案为:冷凝管;2Na2O2+2H2O=4NaOH+O2↑或2H2O
=2H2O+O2↑,故答案为:冷凝管;2Na2O2+2H2O=4NaOH+O2↑或2H2O![]() =2H2O+O2↑;
=2H2O+O2↑;
(2)装置C中为PCl3与氧气反应生成POCl3的反应,化学方程式为2PCl3+O2=2POCl3,故答案为:2PCl3+O2=2POCl3;
(3)通过加热可以加快反应速率,但温度不易太高,防止PCl3气化,影响产量,则C装置易控制反应在60℃65℃进行,故答案为:加快反应速率,同时防止PCl3气化,逸出损失;
(4)①用cmolL1NH4SCN溶液滴定过量Ag+至终点,当滴定达到终点时NH4SCN过量,加NH4Fe(SO4)2作指示剂,Fe3+与SCN反应溶液会变红色,半分钟内不褪色,即可确定滴定终点;故答案为:b;当加入最后一滴NH4SCN溶液,溶液刚好变为红色,且红色半分钟内不褪色;
②用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL,则过量Ag+的物质的量为Vc×103mol,与Cl反应的Ag+的物质的量为0.1000mol/L×0.04LVc×103mol=(4Vc)×103mol,则Cl元素的质量百分含量为![]() ,故答案为:
,故答案为:![]() ;
;
③已知:Ksp(AgCl)=3.2×1010,Ksp(AgSCN)=2×1012,则AgSCN沉淀的溶解度比AgCl小,可加入硝基苯用力摇动,使AgCl沉淀表面被有机物覆盖,避免在滴加NH4SCN时,将AgCl沉淀转化为AgSCN沉淀;若无此操作,NH4SCN与AgCl反应生成AgSCN沉淀,反应为:AgCl(s)+SCN-(aq)![]() AgSCN(s)+Cl-(aq);则滴定时消耗的NH4SCN标准液的体积偏多,即银离子的物质的量偏大,则与氯离子反应的银离子的物质的量偏小,所以测得的氯离子的物质的量偏小;故答案为:AgCl(s)+SCN-(aq)
AgSCN(s)+Cl-(aq);则滴定时消耗的NH4SCN标准液的体积偏多,即银离子的物质的量偏大,则与氯离子反应的银离子的物质的量偏小,所以测得的氯离子的物质的量偏小;故答案为:AgCl(s)+SCN-(aq)![]() AgSCN(s)+Cl-(aq);偏小。
AgSCN(s)+Cl-(aq);偏小。