题目内容
11.下列反应的离子方程式书写正确的是( )| A. | 锌粒与醋酸反应:Zn+2H+═Zn2++H2↑ | |
| B. | 碘化钾溶液与氯气反应:2I-+Cl2═2Cl-+2I | |
| C. | 氢氧化钡与稀硫酸反应:Cu2++2OH-+2H++SO42-═2H2O+BaSO4↓ | |
| D. | 氯气与水反应:Cl2+H2O═2H++ClO-+Cl- |
分析 A.醋酸为弱酸,应保留化学式;
B.二者反应生成氯化钾和单质碘;
C.二者反应生成硫酸钡和水;
D.次氯酸为弱电解质,保留化学式.
解答 解:A.锌粒与醋酸反应,离子方程式:Zn+2CH3COOH═Zn2++H2↑+2CH3COO-,故A错误;
B.碘化钾溶液与氯气反应,离子方程式:2I-+Cl2═2Cl-+I2,故B错误;
C.氢氧化钡与稀硫酸反应,离子方程式:Cu2++2OH-+2H++SO42-═2H2O+BaSO4↓,故C正确;
D.氯气与水反应,离子方程式:Cl2+H2O=H++HClO-+Cl-,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式的拆分,注意离子反应必须遵循客观事实,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列有机反应方程式正确的是( )
| A. | CH3CH3+Cl2 $\stackrel{光照}{→}$ CH2=CH2+2HCl | |
| B. | CH2=CH2+Br2→CH3CHBr2 | |
| C. | CH3CH2OH+O2$→_{△}^{Cu}$CH3CHO+H2O | |
| D. | CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O |
16.下列关于Li、Na、K、Rb、Cs的叙述均正确的一组是( )
①金属性最强的是铯
②氧化性最强的是锂原子
③在自然界中均以化合态形式存在
④它们的氧化物都只有M2O、M2O2两种形式
⑤铯与水反应十分剧烈,甚至会发生爆炸
⑥密度按Li-Cs顺序呈依次递增趋势
⑦离子半径:Rb+>K+>Na+、Cs>Cs+>K+
⑧都可以保存在煤油中.
①金属性最强的是铯
②氧化性最强的是锂原子
③在自然界中均以化合态形式存在
④它们的氧化物都只有M2O、M2O2两种形式
⑤铯与水反应十分剧烈,甚至会发生爆炸
⑥密度按Li-Cs顺序呈依次递增趋势
⑦离子半径:Rb+>K+>Na+、Cs>Cs+>K+
⑧都可以保存在煤油中.
| A. | ①③⑤⑦ | B. | ①④⑤⑥⑦ | C. | ①②⑥⑧ | D. | ①③④⑤ |
20.下列反应的离子方程式书写正确的是( )
| A. | 在澄清石灰水中加入少量小苏打:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| B. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| C. | 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO | |
| D. | 将标准状况下112mL氯气通入10mL浓度为1mol•L-1的溴化亚铁溶液中:2Fe2++4Br-+3Cl2=3Fe3++6Cl-+2Br2 |
1.下列离子方程式中,正确的是( )
| A. | 向Na2S溶液中滴加NaClO溶液:S2-+ClO-+H2O=S↓+Cl-+2OH- | |
| B. | NH4HSO3溶于过量NaOH溶液中:HSO3-+OH-=SO32-+H2O | |
| C. | 向氯化银悬浊液中滴入饱和碘化钾溶液:Ag++I-=AgI | |
| D. | 标准状况下672mL Cl2通入100mL 1mol•L-1 FeBr2溶液中:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |


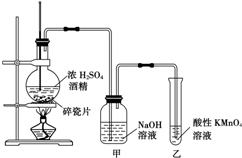 如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置.请回答:
如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置.请回答: