题目内容
设NA表示阿伏加德罗常数的值,下列叙述正确的是( )A.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%
B.通常状况下,NA个CO2分子的体积大于22.4L
C.100mL0.1mol/L的H2SO4溶液中H+的个数是0.2NA
D.若1gN2含有m个分子,则NA=m/28
【答案】分析:A、根据密度和体积计算溶液的总质量,根据硫酸的浓度越大密度越大,判断质量分数关系.
B、标准状况下,气体摩尔体积为22.4L/mol,再相同压强下,温度越高气体摩尔体积越大,据此判断.
C、0.1mol/L的H2SO4溶液中H+的浓度为0.2mol/L,根据N=cVNA计算H+的个数.
D、根据n=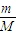 计算氮气的物质的量,再根据N=nNA计算阿伏伽德罗常数.
计算氮气的物质的量,再根据N=nNA计算阿伏伽德罗常数.
解答:解:A、设98%的H2SO4溶液密度为ρ1,稀释后硫酸的密度为ρ2,因硫酸的浓度越大密度越大,则ρ1>ρ2,则稀释后溶液的质量分数为w(H2SO4)=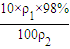 ×100%=9.8%×
×100%=9.8%×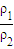 >9.8%,故A错误;
>9.8%,故A错误;
B、在相同压强下,温度越高气体摩尔体积越大,所以通常状况下,气体摩尔体积大于22.4L/mol,NA个CO2分子的物质的量为1mol,所以二氧化碳气体的体积大于22.4L,故B正确.
C、0.1mol/L的H2SO4溶液中H+的浓度为0.2mol/L,所以100ml该溶液中H+的个数为0.1L×0.2mol/L×NAmol-1=0.02NA,(若考虑水的电离,则H+的个数大于0.02NA),故C错误;
D、1gN2的物质的量为 =
=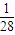 mol,所以m=
mol,所以m=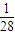 mol×NA,故NA=28mmol-1,故D错误.
mol×NA,故NA=28mmol-1,故D错误.
故选:B.
点评:本题考查常用化学计量的有关计算,题目难度不大,注意硫酸的浓度越大,密度越大.
B、标准状况下,气体摩尔体积为22.4L/mol,再相同压强下,温度越高气体摩尔体积越大,据此判断.
C、0.1mol/L的H2SO4溶液中H+的浓度为0.2mol/L,根据N=cVNA计算H+的个数.
D、根据n=
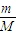 计算氮气的物质的量,再根据N=nNA计算阿伏伽德罗常数.
计算氮气的物质的量,再根据N=nNA计算阿伏伽德罗常数.解答:解:A、设98%的H2SO4溶液密度为ρ1,稀释后硫酸的密度为ρ2,因硫酸的浓度越大密度越大,则ρ1>ρ2,则稀释后溶液的质量分数为w(H2SO4)=
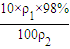 ×100%=9.8%×
×100%=9.8%×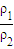 >9.8%,故A错误;
>9.8%,故A错误;B、在相同压强下,温度越高气体摩尔体积越大,所以通常状况下,气体摩尔体积大于22.4L/mol,NA个CO2分子的物质的量为1mol,所以二氧化碳气体的体积大于22.4L,故B正确.
C、0.1mol/L的H2SO4溶液中H+的浓度为0.2mol/L,所以100ml该溶液中H+的个数为0.1L×0.2mol/L×NAmol-1=0.02NA,(若考虑水的电离,则H+的个数大于0.02NA),故C错误;
D、1gN2的物质的量为
 =
=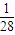 mol,所以m=
mol,所以m=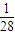 mol×NA,故NA=28mmol-1,故D错误.
mol×NA,故NA=28mmol-1,故D错误.故选:B.
点评:本题考查常用化学计量的有关计算,题目难度不大,注意硫酸的浓度越大,密度越大.

练习册系列答案
相关题目