题目内容
(11分)有一种白色粉末是无水碳酸钠和碳酸氢钠的混合物,称取4.42g灼烧至恒重,把放出的气体通入足量澄清石灰水中,生成2.00g沉淀,灼烧后的残渣能与30.0mL盐酸恰好完全反应。试求:
(1)原混合物中各物质的质量。 (2)所用盐酸的物质的量浓度。
(1)原混合物中各物质的质量。 (2)所用盐酸的物质的量浓度。
(1)以碳酸氢钠的质量为3.36g,碳酸钠的质量为1.06g
(2)2.00mol/L
(2)2.00mol/L
(12分)解:设碳酸钠 和碳酸氢钠的物质的量分别是x、y
和碳酸氢钠的物质的量分别是x、y
2NaHCO3==Na2CO3+CO2↑+H2O Ca(OH)2+CO2 = H2O +CaCO3↓
y y/2 y/2 y/2 y/2
2.00g CaCO3的物质的量为0.02mol,
所以碳酸氢钠的物质的量为0.04mol,质量为3.36g,碳酸钠的质量为1.06g
即x="0.01mol " y="0.04mol " (6分)
Na2CO3+2HCl="2NaCl+" CO2↑+H2O
(x+y/2) 2x+y
所以,HCl的物质的量浓度c(HCl)="(2x+y)/0.03L=2.00mol/L " (5分)
 和碳酸氢钠的物质的量分别是x、y
和碳酸氢钠的物质的量分别是x、y2NaHCO3==Na2CO3+CO2↑+H2O Ca(OH)2+CO2 = H2O +CaCO3↓
y y/2 y/2 y/2 y/2
2.00g CaCO3的物质的量为0.02mol,
所以碳酸氢钠的物质的量为0.04mol,质量为3.36g,碳酸钠的质量为1.06g
即x="0.01mol " y="0.04mol " (6分)
Na2CO3+2HCl="2NaCl+" CO2↑+H2O
(x+y/2) 2x+y
所以,HCl的物质的量浓度c(HCl)="(2x+y)/0.03L=2.00mol/L " (5分)

练习册系列答案
相关题目
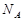 表示阿伏加德罗常数,下列说法正确的是
表示阿伏加德罗常数,下列说法正确的是