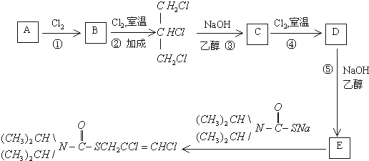
题目内容
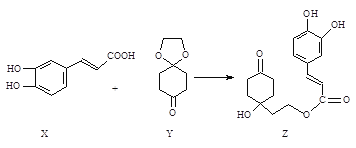
【题目】药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(咖啡酸)和Y(1,4
-环己二酮单乙二醇缩酮)为原料合成(如下图)。
试填空:
(1)X的分子式为_______;该分子中最多共面的碳原子数为________。
(2)Y中是否含有手性碳原子_____(填“是”或“否”)。
(3)Z能发生_______反应。(填序号)
A.取代反应 B.消去反应 C.加成反应
(4)1 mol Z与足量的氢氧化钠溶液充分反应,需要消耗氢氧化钠________mol;
1 mol Z在一定条件下与足量H2充分反应,需要消耗H2 ________mol。
【答案】C9H8O4 9 否 ABC 3 5
【解析】
(1)根据X的键线式,每个端点和拐点都是一个碳,再根据碳四价规则补足氢原子,可知分子式为C9H8O4 ;根据苯环和碳碳双键的空间构型分析,该分子中最多共面的碳原子数为9。
(2)Y中不存在一个碳连接有四个不同的原子或原子团,故没有手性碳原子。
(3)Z中含有官能团醇羟基,碳碳双键,酯基,羰基,能发生A.取代反应(羟基,酯基,);B.消去反应(羟基)C.加成反应(碳碳双键,羰基)。
(4)酚羟基和酯基都能和氢氧化钠反应,1 mol Z与足量的氢氧化钠溶液充分反应,需要消耗氢氧化钠3mol;除酯基不能加成之外,1 mol Z在一定条件下与足量H2充分反应,需要消耗H25mol。

【题目】毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质)。实验室利用毒重石制备BaCl2·2H2O的流程如图:
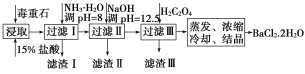
(1)毒重石用盐酸浸取前需充分研磨,目的是__。
(2)加入NH3·H2O调pH=8可除去__(填离子符号),滤渣Ⅱ中含__(填化学式)。加入H2C2O4时应避免过量,原因是__。
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+=Cr2O72-+H2O
Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取xmL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0mL。
步骤Ⅱ:移取ymLBaCl2溶液于锥形瓶中,加入xmL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的__(填“上方”或“下方”)。BaCl2溶液的浓度为__mol·L-1。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将__(填“偏大”或“偏小”)。