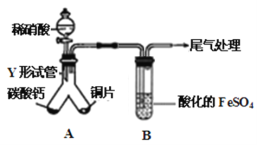
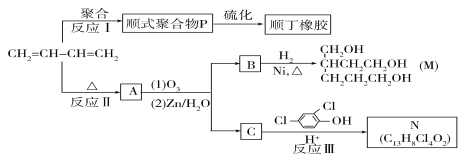
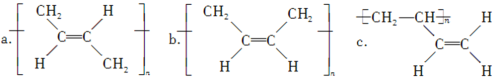
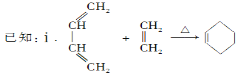题目内容
【题目】常温下,现有浓度都为0.1mol·L-1HX、HY的溶液各20ml,分别用0.1 mol·L-1NaOH溶液滴定。溶液的pH与加入NaOH溶液体积V的关系如图所示。

下列判断错误的是
A.滴定过程中,水电离的c(H+)·c(OH-)均不变
B.HX的电离程度小于HY的电离程度
C.V=10ml时,c(HX)+c(X-)=2c(Na+)
D.V=20ml时,c(Y-)>c(X-)
【答案】A
【解析】
试题分析:A.中和反应是放热反应,反应过程中温度会逐渐升高,水电离的c(H+)·c(OH-)会逐渐增大,故A错误;B.根据图像,浓度都为0.1mol·L-1HX、HY的溶液,HX的pH大于1,说明酸性HX<HY,HX电离程度小于HY的电离程度,故B正确;C.V=10ml时,溶液中存在等浓度的HX和NaX,存在物料守恒,c(HX)+c(X-)=2c(Na+),故C正确;D.V=20ml时,恰好完全中和,由于酸性HX<HY,X-存在水解,因此c(Y-)>c(X-),故D正确;故选A。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】向有机物X中加入合适的试剂(可以加热),检验其官能团。下列有关结论不正确的是:( )
选项 | 试剂 | 现象 | 结论 |
A | 金属钠 | 有气体产生 | 含羟基 或羧基 或羟基和羧基 |
B | 银氨溶液 | 产生银镜 | 含有醛基 |
C | 碳酸氢钠溶液 | 产生气泡 | 含有羧基 |
D | 溴水 | 溶液褪色 | 含有碳碳双键 |