题目内容
下列图示的有关说法正确的是
| A.装置①中负极反应式为H2+2e一=2H+ |
| B.装置①工作时,外电路电子由a电极流向b电极 |
| C.若采用装置②精炼铜,则d为粗铜,c为纯铜 |
| D.若装置②用惰性电极电解稀H2SO4溶液,则溶液pH升高 |
B
解析试题分析:A、装置1是原电池,其中通入氢气的电极是负极,氢气失去电子,电极反应式为H2-2e一=2H+,A不正确;B、装置1中a电极是负极,b电极是正极,因此装置①工作时,外电路电子由a电极流向b电极,B正确;C、根据电流方向可知,装置2中a是正极,b是负极,因此若采用装置②精炼铜,则c为粗铜,d为纯铜,C不正确;D、若装置②用惰性电极电解稀H2SO4溶液,实质是电解水,硫酸浓度增大,酸性增强,则溶液pH降低,D不正确,答案选B。
考点:考查电化学原理的有关应用与判断

用电解法制取KIO3的方法是以石墨和铁为电极电解KI溶液,电解反应方程式为
KI + 3H2O KIO3 + 3H2↑。下列说法中正确的是
KIO3 + 3H2↑。下列说法中正确的是
| A.电解时石墨作阴极 |
| B.电解时阳极上产生H2 |
| C.电解过程中阴极区溶液pH升高 |
| D.阴极电极反应式:I-- 6e-+ 3H2O = IO3-+ 6H+ |
如图所示,?为直流电源,?为浸透饱和氯化钠溶液和酚酞试液的滤纸,?为电镀槽。接通电路(未闭合K)后发现?上的c点显红色。为实现铁片上镀铜,接通K后,使c、d两点短路。下列叙述不正确的是( )。
| A.b为直流电源的负极 |
| B.f极为阴极,发生还原反应 |
| C.e极材料为铁片,f极材料为铜片 |
| D.可选用CuSO4溶液或CuCl2溶液作电镀液 |
已知空气-锌电池的电极反应:
锌片:Zn-2OH--2e-=ZnO+H2O,
石墨:1/2O2+H2O+2e-=2OH-
据此推断锌片是( )
| A.负极,被氧化 | B.负极,被还原 |
| C.正极,被氧化 | D.正极,被还原 |
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1 mol电子流过导线,则产生的H2为0.5 mol;
⑥正极的电极反应式为Zn-2e-=Zn2+
| A.①②③ | B.③④⑤ | C.④⑤⑥ | D.②③④ |
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为4Al+3O2+6H2O=4Al(OH)3,下列说法不正确的是( )
| A.正极反应式为O2+2H2O+4e-=4OH- |
| B.电池工作时,电流由铝电极沿导线流向铂电极 |
| C.以网状的铂为正极,可增大与氧气的接触面积 |
| D.该电池通常只需要换铝板就可以继续使用 |
某化学学习小组学习电化学后,设计了下面的实验装置图: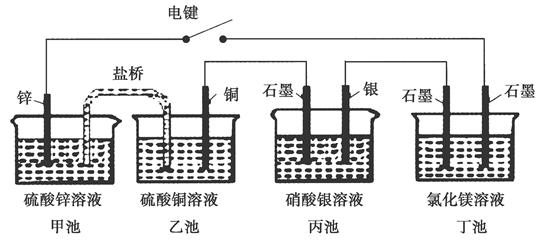
下列有关该装置图的说法中正确的是( )
| A.合上电键后,盐桥中的阳离子向甲池移动 |
| B.合上电键后,丙池为电镀银的电镀池 |
| C.合上电键后一段时间,丙池中溶液的pH增大 |
| D.合上电键后一段时间,当丙池中生成标准状况下560 mL气体时,丁池中理论上最多产生2.9 g固体 |
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是( )
| A.由TiO2制得1 mol金属Ti,理论上外电路转移2 mol电子 |
| B.阳极的电极反应式为C+2O2--4e-=CO2↑ |
| C.在制备金属钛前后,整套装置中CaO的总量减少 |
| D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极 |