题目内容
【题目】物质的结构决定物质的性质。请回答下列涉及物质结构和性质的问题:
(1)第二周期中,元素的第一电离能处于B与N之间的元素有_____种。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为_____。
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到。乙烯酮分子中碳原子杂化轨道类型是_____,1mol(C2H5O)3P=O分子中含有的σ键的数目为_____。
(4)已知固态NH3、H2O、HF的氢键键能和结构如图1:
物质 | 氢键X﹣H…Y | 键能kJ.mol﹣1 |
(HF)n | D﹣H…F | 28.1 |
冰 | O﹣H…O | 18.8 |
(NH3)n | N﹣H…N | 5.4 |

解释H2O、HF、NH3沸点依次降低的原因_____。
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能。碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有_____个,与碳原子等距离最近的碳原子有_____个。已知碳化硅晶胞边长为apm,则晶胞图2中1号硅原子和2号碳原子之间的距离为_____pm,碳化硅的密度为_____g/cm3。
【答案】 3 3d84s2 sp2、sp 25NA 单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n 4 12 ![]()
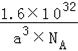
【解析】(1)同周期元素的第一电离能从左到右呈增大趋势,但是由于氮原子的2p轨道处于半充满状态,较稳定,其第一电离能比氧的大,铍原子的2s轨道处于全满状态,铍的第一电离能比硼的大,所以第一电离能介于硼和氮之间的第2周期元素有铍、碳、氧3种元素;(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,即未对电子数为2,因此该元素的价层电子排布式为3d84s2;(3)乙烯酮分子中2个碳原子均没有孤对电子,碳原子的杂化轨道数目为3、2,所以碳原子杂化类型为sp2、sp;单键为σ键,双键中含有1个σ键、1个π键,因此(C2H5O)3P=O分子中含有25个σ键,则1mol(C2H5O)3P=O分子中含有的σ键的数目为25NA;(4)由于单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n均只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n,所以H2O、HF、NH3沸点依次降低;(5)晶胞中Si原子数目为4、C原子数目为8×1/8+6×1/2=4,每个Si原子周围有4个碳原子,原子配位数与原子数目成反比,则碳原子配位数也是4,即碳原子周围与其距离最近的硅原子数目为4;以顶点C原子为研究对象,与之距离最近的C原子位于面心上,每个顶点原子为8个晶胞共用,每个面为2个晶胞共用,因此与碳原子等距离最近的碳原子有![]() 个;作过1号Si原子的体对角线、2号碳原子的体对角线,相交于体心O点,与顶点碳原子形成如图所示:
个;作过1号Si原子的体对角线、2号碳原子的体对角线,相交于体心O点,与顶点碳原子形成如图所示: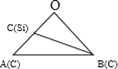 ,其中B为2号碳原子,C为1号Si原子,1号Si原子与周围的4个C原子形成正四面体,1号Si原子与顶点碳原子连线处于晶胞体对角线上,且距离为体对角线长度的1/4,体对角线长度为
,其中B为2号碳原子,C为1号Si原子,1号Si原子与周围的4个C原子形成正四面体,1号Si原子与顶点碳原子连线处于晶胞体对角线上,且距离为体对角线长度的1/4,体对角线长度为![]() pm,则OA=OB=
pm,则OA=OB=![]() pm,所以OC=
pm,所以OC=![]() pm,则:
pm,则: 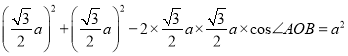 ,解得cos∠AOB=1/3,故
,解得cos∠AOB=1/3,故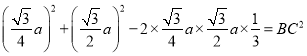 ,解得BC=
,解得BC= ![]() ,晶胞质量为
,晶胞质量为![]() ,则晶体密度为
,则晶体密度为![]() ÷(a×10-10 cm)3=
÷(a×10-10 cm)3=![]() g/cm3。
g/cm3。

【题目】某课外兴趣小组对H2O2的分解速率做了如下实验探究.
下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)
(1)该研究小组在设计方案时.考虑了浓度、、等因素对过氧化氢分解速率的影响.
从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响 .
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试.测定结果如下:
催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
①写出H2O2发生的化学反应方程式 .
②实验结果说明催化剂作用的大小与有关.
