题目内容
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A.1molN2与3molH2反应生成的NH3分子数为2NA
B.14g乙烯(C2H4)和丙烯(C3H6)混合气体中的原子总数为3NA
C.1molFe溶于过量硝酸,电子转移数为2NA
D.标准状况下,2.24LCCl4含有的共价键数为0.4NA
【答案】B
【解析】
A.1molN2与3molH2反应生成的NH3,因反应为可逆反应1mol氮气不能全部反应生成氨气,生成氨气分子数小于2NA,A选项错误;
B.14g乙烯和丙烯混合气体中含CH2物质的量=![]() =1mol,含氢原子数为2NA,B选项正确;
=1mol,含氢原子数为2NA,B选项正确;
C.1mol Fe溶于过量硝酸生成硝酸铁,电子转移为3mol,电子转移数为3NA,C选项错误;
D.标准状况下,四氯化碳不是气体,2.24L CCl4的物质的量不是0.1mol,D选项错误;
答案选B。

 习题精选系列答案
习题精选系列答案【题目】电解质水溶液中存在电离平衡、水解平衡等,请回答下列问题。
(1)已知部分弱电解质的电离常数如下表:
弱电解质 | NH3.H2O | HCOOH | HCN | H2CO3 |
电离常数(25℃) | Kb = 1.8×10 5 | Ka = 1. 77×10 4 | Ka=4.3×1010 | Ka1=5.0×107 Ka2=5.6×1011 |
① 已知25℃时,HCOOH( aq) +OH ( aq)=HCOO(aq) +H2O(l) △H=a kJ/mol H+(aq) +OH(aq) =H2O(l) △H=b kJ/mol 甲酸电离的热化学方程式为______________。
②取浓度相同的上述三种酸溶液,溶液pH最大的是_________,稀释相同的倍数后,溶液pH变化最大的是____________________。
③分别取等浓度、等体积HCOOH和HCN溶液,加入同浓度的NaOH溶液中和,当溶液呈中性时消耗NaOH溶液的体积:V (HCOOH)______ V (HCN) (填“>”、“<”或“=”)。
④0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN)______c(HCO3 )(填“>”、“<”或“=”)。
⑤常温下,pH相同的三种溶液a.HCOONa b.NaCN c.Na2CO3,其物质的量浓度由大到小的顺序是_____________(填编号)。
⑥将少量CO2通入NaCN溶液,反应的离子方程式是__________________________________。
⑦若NH3·H2O与CO2恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。向该溶液中通入________气体可使溶液呈中性(填“CO2”或“NH3”)。此时溶液中c(NH4+)/c(CO3 2) ________2(填“>”“<”或“=”)
(2)室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。

① HA的电离方程式是____________________________
② a、b、c处溶液中水的电离程度最大的是_______________
③ c点所示的溶液中除水分子外的微粒浓度由大到小的顺序依次为______________________________。
(3)常温下,将等体积0.1 molL-1NaOH和n molL-1HA混合,溶液呈中性,该温度下HA的电离常数Ka=___________(用含有n的式子表达)
【题目】三氯化磷(PCl3)是一种用于有机合成的重要催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如图所示。
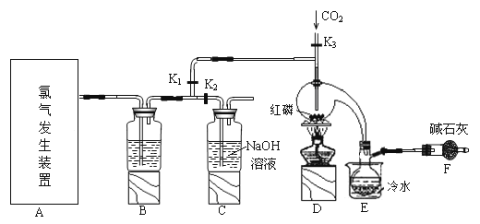
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
物质 | 相对分子质量 | 熔点/℃ | 沸点/℃ |
PCl3 | 137.5 | -112 | 75.5 |
POCl3 | 153.5 | 2 | 105.3 |
请回答下列问题:
(1)请从下图中选择制备氯气的发生装置
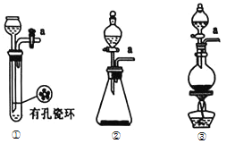
你选用的装置是____(填序号),反应的离子方程式为____。
(2)B中所盛试剂是_____。
(3)E中冷水的作用是____。
(4)仪器F的名称是____;F中碱石灰的作用是___。
(5)实验制得的粗产品中常含有POCl3、PCl5等,加入红磷加热除去PCl5后,再通过__(填操作名称)即可得到较纯净的PCl3。
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000 mol/LNa2S2O3溶液8.00mL。
己知:H3PO3+I2+H2O=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为___(保留3位有效数字)。