题目内容
下列事实可证明氨水中的(NH3?H2O)是弱碱的是
| A.氨水能被弱酸醋酸中和 | B.铵盐受热易分解 |
| C.氨水可以使酚酞试液变红 | D.常温下,0.1 mol/L氯化铵溶液的pH约为5 |
D
解析试题分析:常温下,0.1 mol/L氯化铵溶液的pH约为5,说明氯化铵是强酸弱碱盐,可证明氨水中的(NH3?H2O)是弱碱。
考点:弱电解质的证明

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
常温下,浓度均为0.1mol/L CH3COOH溶液和HCN溶液的pH分别为m和n(1<m<n)。
下列叙述中不正确的是
| A.常温下,pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,前者pH变化小 |
| B.等温下,等浓度的CH3COONa和NaCN溶液pH,后者大 |
| C.HCN溶液和NaOH溶液不等体积混合后一定存在C(H+)―C(OH-)=C(CN-)―C(Na+) |
| D.溶液中由水电离出的C(H+),前者是后者的10m-n倍 |
下列溶液中各微粒浓度关系判定不正确的是
| A.10mL 0.2 mol·L-1的氨水与l0mL 0.1 mol·L-1的盐酸充分反应混合后的溶液中,存在c(NH4+)+c(NH3·H2O)=2c(Cl-)= 0.1 mol·L-1 |
| B.已知酸性HF > CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+) - c(F-) >c(K+) - c(CH3COO-) |
| C.CH3COOK溶液中加入少量NaNO3固体后的碱性溶液一定有:c(K+)+c(H+)=c(CH3COO-)+c(OH-) |
| D.已知NaHS03溶液pH<7,该溶液中一定有:c(Na+)> c(HSO3-)> c(SO32-)>c(H2SO3) |
将下列气体通入水中,其饱和水溶液酸性最强的是
| A.CH4 | B.NH3 | C.HBr | D.SO2 |
下列水溶液一定呈碱性的是
| A.pH=8的溶液 | B.含有OH-离子的溶液 |
| C.NaCl溶液 | D.c(OH-)>c(H+)的溶液 |
能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的措施是
| A.向水中通入SO2 | B.将水加热煮沸 |
| C.向纯水中投入一小块金属钠 | D.向水中加入NaCl |
下列液体均处于25 ℃,有关叙述正确的是 ( )。
| A.某物质溶液的pH>7,则该物质一定是碱或强碱弱酸盐 |
| B.pH=6.5的牛奶中c(H+)是pH=4.5的H2SO4溶液中c(H+)的100倍 |
| C.pH=3的醋酸与pH=11的NaOH溶液等体积混合后溶液中: c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.AgCl在等浓度的CaCl2溶液和NaCl溶液中的溶解度相同 |
常温下,有关醋酸溶液的叙述中错误的是(双选) ( )。
| A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) |
B.将pH=3的醋酸稀释为pH=4的过程中,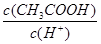 比值不变 比值不变 |
| C.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| D.a mL pH=3的醋酸溶液与b mL pH=11的NaOH溶液恰好完全中和时,a=b |
