题目内容
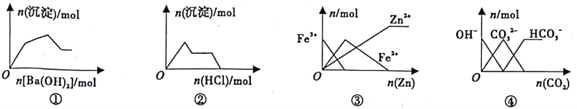
【题目】随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.根据判断出的元素回答下列问题:
(1)f在元素周期表的位置是 .
(2)比较y、g、h最高价氧化物对应水化物的酸性强弱是:>> . (用化学式表示)
(3)由表中两种元素的原子按1:1组成的化合物A和B,A中既含离子键又含非极性共价键,其电子式为;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为 . (填序号)A.MnO2B.FeCl3C.Na2SO3D.KMnO4
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:  ①X溶液与Y溶液反应的离子方程式为
①X溶液与Y溶液反应的离子方程式为
②常温下,为使0.1mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至
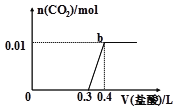
(5)上述元素可组成盐R:zx4f(gd4)2 , 向盛有10mL 1molL﹣1 R溶液的烧杯中滴加1molL﹣1NaOH溶液,沉淀的物质的量随NaOH溶液体积变化如图所示:
①写出m点反应的离子方程式 .
②若R溶液中改加20mL 1.2molL﹣1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为mol.
【答案】
(1)第三周期ⅢA族
(2)HClO4;H2SO4;H2CO3
(3)![]() ;AB
;AB
(4)Al3++3NH3?H2O=Al(OH)3↓+3NH4+;溶液呈中性
(5)NH4++OH﹣=NH3?H2O;0.022
【解析】解:从图中的化合价和原子半径的大小,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.(1)f是Al元素,在元素周期表的位置是第三周期ⅢA族,所以答案是:第三周期ⅢA族;(2)非金属性越强,最高价氧化物水化物的酸性越强,故酸性:HClO4>H2SO4>H2CO3 ,
所以答案是:HClO4>H2SO4>H2CO3;(3)由表中两种元素的原子按1:1组成的化合物A和B,A中既含离子键又含非极性共价键,则A为Na2O2 , 其电子式为 ![]() ,B是常见的液态化合物,其稀溶液易被催化分解,则B为H2O2 , 能使双氧水解的催化剂为MnO2、FeCl3 , 故选AB,
,B是常见的液态化合物,其稀溶液易被催化分解,则B为H2O2 , 能使双氧水解的催化剂为MnO2、FeCl3 , 故选AB,
所以答案是: ![]() ;AB;(4)①由
;AB;(4)①由 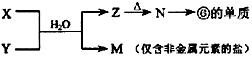 反应转化可知,f为Al元素,则N为Al2O3 , Z为Al(OH)3 , M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,X溶液与Y溶液反应的离子方程式为Al3++3NH3H2O=Al(OH)3↓+3NH4+ ,
反应转化可知,f为Al元素,则N为Al2O3 , Z为Al(OH)3 , M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,X溶液与Y溶液反应的离子方程式为Al3++3NH3H2O=Al(OH)3↓+3NH4+ ,
所以答案是:Al3++3NH3H2O=Al(OH)3↓+3NH4+;
②M溶液中铵根离子水解呈酸性,要使0.1mol/L M 溶液中由M电离的阴、阳离子浓度相等,根据溶液的电中性可知c(H+)=c(OH﹣),所以应向溶液中加入一定量的Y溶液至溶液呈中性,
所以答案是:溶液呈中性;(5)①m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH﹣反应生成NH3H2O,离子方程式为:NH4++OH﹣=NH3H2O,
所以答案是:NH4++OH﹣=NH3H2O;
②10mL 1molL﹣1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42﹣的物质的量为0.02mol,20mL 1.2 molL﹣1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH﹣为0.048mol,
由SO42﹣+Ba2+=BaSO4↓,可知SO42﹣不足,故可以得到0.02mol BaSO4 ,
Al3++3OH﹣=Al(OH)3↓
0.01mol 0.03mol 0.01mol
反应剩余OH﹣为0.048mol﹣0.03mol=0.018mol,
NH4++OH﹣=NH3H2O
0.01mol 0.01mol
反应剩余OH﹣为0.018mol﹣0.01mol=0.008mol,
Al(OH)3+OH﹣=AlO2﹣+2H2O
0.008mol 0.008mol
故得到Al(OH)3沉淀为0.01mol﹣0.008mol=0.002mol
则最终得到固体为0.02mol+0.002mol=0.022mol,
所以答案是:0.022.