题目内容
短周期原子序数依次递增的A、B、C、D、E、F六种元素,已知B原子最外层电子数是A原子次外层电子数的3倍,是D原子最外层电子数的2倍;C原子内层电子总数是最外层电子数10倍;A、B、D三种元素的原子最外层电子数之和为13;A和B原子最外层电子数与D和F原子最外层电子数之和相等;D和E是相邻两种元素.
(1)E元素原子的结构示意图 ;F元素的名称: .
(2)A、B、E、F四种元素气态氢化物熔沸点由高到低的顺序是 ;(用化学式回答)
(3)由A、B、C三种元素组成原子个数比nA:nB:nC=1:3:2的化合物水溶液呈碱性的原因是 .(用离子方程式回答)
(4)有人认为D和F形成的化合物是共价化合物,而不是离子化合物,确证的方法是: .
(5)E和F形成的化合物X是工业生产纯净E单质的中间体,工业上用X制取高纯度的单质E的化学原理是 .(写化学反应方程式)
(1)E元素原子的结构示意图
(2)A、B、E、F四种元素气态氢化物熔沸点由高到低的顺序是
(3)由A、B、C三种元素组成原子个数比nA:nB:nC=1:3:2的化合物水溶液呈碱性的原因是
(4)有人认为D和F形成的化合物是共价化合物,而不是离子化合物,确证的方法是:
(5)E和F形成的化合物X是工业生产纯净E单质的中间体,工业上用X制取高纯度的单质E的化学原理是
分析:已知B原子最外层电子数是A原子次外层电子数的3倍,是D原子最外层电子数的2倍,说明B元素最外层电子数为6,D原子最外层电子数为3,A的次外层电子数为2;C原子内层电子总数是最外层电子数10倍,则C为Na;A、B、D三种元素的原子最外层电子数之和为13,则A的最外层为13-6-3=4,所以A的核外电子数为2+4=6为C元素;A和B原子最外层电子数与D和F原子最外层电子数之和相等,则F的最外层为7,F的原子序数最大,应为Cl元素;D和E是相邻两种元素,D原子最外层电子数为3,所以D为Al元素,E为Si元素;B元素最外层电子数为6,且原子序数比Na,则为O元素,综上可知:A为C元素,B为O元素,C为Na元素,D为Al元素,E为Si元素,F为Cl元素;结合元素对应单质化合物的性质以及元素周期律解答该题.
解答:解:已知B原子最外层电子数是A原子次外层电子数的3倍,是D原子最外层电子数的2倍,说明B元素最外层电子数为6,D原子最外层电子数为3,A的次外层电子数为2;C原子内层电子总数是最外层电子数10倍,则C为Na;A、B、D三种元素的原子最外层电子数之和为13,则A的最外层为13-6-3=4,所以A的核外电子数为2+4=6为C元素;A和B原子最外层电子数与D和F原子最外层电子数之和相等,则F的最外层为7,F的原子序数最大,应为Cl元素;D和E是相邻两种元素,D原子最外层电子数为3,所以D为Al元素,E为Si元素;B元素最外层电子数为6,且原子序数比Na,则为O元素,综上可知:A为C元素,B为O元素,C为Na元素,D为Al元素,E为Si元素,F为Cl元素;
(1)已知E为Si元素,则其原子的结构示意图为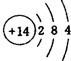 ,F为Cl元素名称为:氯;故答案为:
,F为Cl元素名称为:氯;故答案为: ;氯;
;氯;
(2)水分子间有氢键沸点高,没有氢键的分子量越大沸点越高,所以A、B、E、F四种元素气态氢化物熔沸点由高到低的顺序是H2O>HCl>SiH4>CH4,
故答案为:H2O>HCl>SiH4>CH4;
(3)由A、B、C三种元素组成原子个数比nA:nB:nC=1:3:2的化合物为Na2CO3,碳酸钠中的碳酸根离子会发生水解反应,即CO32-+H2O?HCO3-+OH-,所以Na2CO3溶液呈碱性,故答案为:CO32-+H2O?HCO3-+OH-;
(4)D和F形成的化合物AlCl3,若熔融状态下能导电即是离子化合物,熔融状态不导电则为共价化合物,故答案为:测定其熔融 状态下能否导电,若不导电则为共价化合物,若导电则为离子化合物;
(5)工业上用SiCl4与氢气制取高纯度的单质Si的化学原理是:SiCl4+2H2
Si+4HCl,故答案为:SiCl4+2H2
Si+4HCl;
(1)已知E为Si元素,则其原子的结构示意图为
 ,F为Cl元素名称为:氯;故答案为:
,F为Cl元素名称为:氯;故答案为: ;氯;
;氯;(2)水分子间有氢键沸点高,没有氢键的分子量越大沸点越高,所以A、B、E、F四种元素气态氢化物熔沸点由高到低的顺序是H2O>HCl>SiH4>CH4,
故答案为:H2O>HCl>SiH4>CH4;
(3)由A、B、C三种元素组成原子个数比nA:nB:nC=1:3:2的化合物为Na2CO3,碳酸钠中的碳酸根离子会发生水解反应,即CO32-+H2O?HCO3-+OH-,所以Na2CO3溶液呈碱性,故答案为:CO32-+H2O?HCO3-+OH-;
(4)D和F形成的化合物AlCl3,若熔融状态下能导电即是离子化合物,熔融状态不导电则为共价化合物,故答案为:测定其熔融 状态下能否导电,若不导电则为共价化合物,若导电则为离子化合物;
(5)工业上用SiCl4与氢气制取高纯度的单质Si的化学原理是:SiCl4+2H2
| ||
| ||
点评:本题考查的是有关核外电子排布的推断题,此类型题的解题规律是:先根据题干信息推断元素,再根据元素化合物知识解决有关问题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目