题目内容
4.下列变化中,加入氧化剂可实现的是( )| A. | I-→I2 | B. | Fe3+→Fe2+ | C. | FeO→Fe | D. | HCl→AgCl |
分析 根据给出的变化中元素的化合价若升高,则一般需要加入氧化剂才能实现转化,以此解答该题.
解答 解:A.I元素化合价升高,被氧化,应加入氧化剂,故A正确;
B.Fe元素化合价降低,被还原,应加入还原剂,故B错误;
C.Fe元素化合价降低,被还原,应加入还原剂,故C错误;
D.盐酸与硝酸银反应生成,为复分解反应,故D错误.
故选A.
点评 本题考查氧化还原反应,为高频考点,明确元素的化合价变化是解答本题的关键,注意还原剂中某元素的化合价在反应中升高,则需要加入氧化剂实现氧化还原反应.

练习册系列答案
相关题目
14.在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol):下列说法不正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CO、2mol H2 | 1mol CH3OH | 2mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 平衡时压强(Pa) | P1 | P2 | P3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | c1=c3 | B. | a+c/2<90.7 | C. | 2P2>P3 | D. | α1+α3=1 |
9.“保护环境”是我国的基本国策.下列做法不应该提倡的是( )
| A. | 焚烧秸秆,还肥于田 | B. | 净化废水,循环利用 | ||
| C. | 低碳出行,植树造林 | D. | 开发风能,利用地热 |
14.A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如表:A的气态氢化物能使湿润的红色石蕊试纸变蓝;C单质在实验室一般保存在煤油中;F的最高价氧化物对应水化物既能和酸反应又能和强碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题: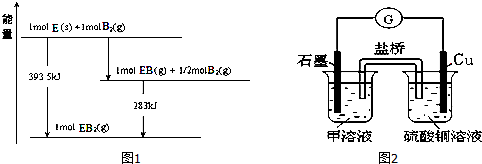
(1)A元素在周期表中的位置是第二周期第VA族.
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:(任写一种)酸雨或光化学烟雾;
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH<7(填“>“或“<”或“=”),若使所得溶液pH=7,则a>b(填“>“或“<”或“=”)
(4)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(5)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.某同学假设正极产物是Fe2+,请你设计实验证明该假设滴加酸性高锰酸钾溶液,若溶液紫色褪去(或滴加铁氰化钾溶液,产生蓝色沉淀),则产品中含有Fe2+.

| … | E | A | B | ||
| C | … | D |
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:(任写一种)酸雨或光化学烟雾;
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH<7(填“>“或“<”或“=”),若使所得溶液pH=7,则a>b(填“>“或“<”或“=”)
(4)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(5)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.某同学假设正极产物是Fe2+,请你设计实验证明该假设滴加酸性高锰酸钾溶液,若溶液紫色褪去(或滴加铁氰化钾溶液,产生蓝色沉淀),则产品中含有Fe2+.

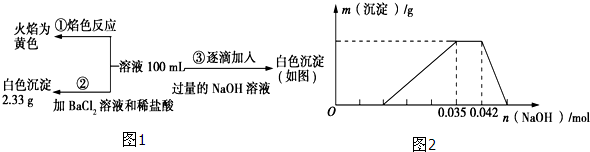
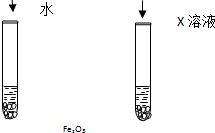 氧化铁可溶于稀盐酸.某同学想知道是稀盐酸中的哪种粒子(H2O、H+、Cl-)能使氧化铁溶解.设计如下实验:
氧化铁可溶于稀盐酸.某同学想知道是稀盐酸中的哪种粒子(H2O、H+、Cl-)能使氧化铁溶解.设计如下实验: