题目内容
某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72—转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
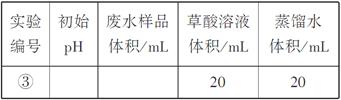
(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
测得实验①和②溶液中的Cr2O72—浓度随时间变化关系如图所示。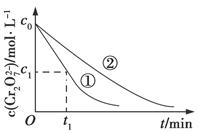
(2)上述反应后草酸被氧化为______________(填化学式)。
(3)实验①和②的结果表明________;实验①中0~t1时间段反应速率v(Cr3+)=________mol·L-1·min-1(用代数式表示)。
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:________;
假设三: ________;
……
(5)请你设计实验验证上述假设一,完成下表中内容。[除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2O72—的浓度可用仪器测定]
| 实验方案 (不要求写具体操作过程) | 预期实验结果和结论 |
| | |
(1)
(2)CO2
(3)溶液pH对该反应的速率有影响 2(c0-c1)/t1
(4)Al3+起催化作用 SO42—起催化作用
(5)实验方案
(不要求写具体操作过程)预期实验结果和结论 用等物质的量K2SO4·Al2(SO4)3·24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 反应进行相同时间后,若溶液中c(Cr2O72—)大于实验①中的c(Cr2O72—),则假设一成立;若两溶液中的c(Cr2O72—)相同,则假设一不成立
(本题属于开放性试题,合理答案均可)
解析

某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有 ________________________________;
(2)要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4 mol·L-1 H2SO4溶液/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
②反应一段时间后,实验A中的金属呈 色,实验E中的金属呈 色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
在某一容积为5 L的密闭容器内,加入0.2mol 的CO和0.2mol的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g),反应放出热量。反应中CO2的浓度随时间变化的情况如下图所示。
CO2(g)+H2(g),反应放出热量。反应中CO2的浓度随时间变化的情况如下图所示。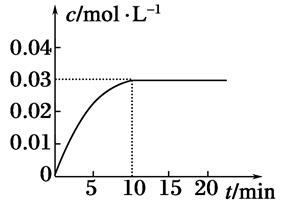
(1)根据图中数据,从反应开始至达到平衡时,CO的化学反应速率为________;反应平衡时c(H2)=________。
(2)判断该反应达到平衡的依据是________(填序号)。
| A.CO减少的化学反应速率和CO2减少的化学反应速率相等 |
| B.CO、H2O、CO2、H2的浓度都相等 |
| C.CO、H2O、CO2、H2的浓度都不再发生变化 |
| D.正、逆反应速率都为零 |
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2 , 化学方程式如下:2NO + 2 CO 2CO2 + N2 ,为了测定在某种催化剂作用下的反应速率,在某温度下,用气体传感器测得不同时间的NO和CO浓度如下表:
2CO2 + N2 ,为了测定在某种催化剂作用下的反应速率,在某温度下,用气体传感器测得不同时间的NO和CO浓度如下表:
| 时间 /s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol·L—1 | 1.00×10—3 | 4.50×10—4 | 2.50×10—4 | 1.50×10—4 | 1.00×10—4 | 1.00×10—4 |
| c(CO)/mol·L—1 | 3.60×10—3 | 3.05×10—3 | 2.85×10—3 | 2.75×10—3 | 2.70×10—3 | 2.70×10—3 |
请回答:(以下各题均不考虑温度变化对催化效率的影响):
(1)前2s内的平均反应速度v (N2)= 。
(2)在该温度下,反应的平衡常数K= ;若升高温度时K值变小,则该反应的ΔH 0(填写“>”、“<”、“=”)。
(3)若在容器中发生上述反应,达平衡后,下列措施能提高NO转化率的是
A. 选用更有效的催化剂 B. 升高反应体系的温度
C. 降低反应体系的温度 D. 缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组对比实验,部分实验条件已经填在下面实验设计表中。请在下面设计表的空格中填入剩余的实验条件数据。
| 实验编号 | T / ℃ | NO初始浓度 ( mol·L—1 ) | CO初始浓度 ( mol·L—1 ) | 催化剂的比表面积 ( m2·g—1 ) |
| Ⅰ | 280 | 1.20 × 10—3 | 5.80 × 10—3 | 82 |
| Ⅱ | | | | 124 |
| Ⅲ | 350 | | | 124 |
工业制硫酸的过程中利用反应2SO2(g)+O2(g)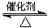 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,则下列说法正确的是 。
A.若反应速率v(SO2)=v(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
E.保持温度和容器体积不变,平衡后再充入2molSO3,再次平衡时各组分浓度均比原平衡时的浓度大
F.平衡后升高温度,平衡常数K增大
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
①实验1从开始到反应达到化学平衡时,v(SO2)表示的反应速率为 ,表中y= 。
②T1 T2 ,(选填“>”、“<”或“=”),实验2中达平衡时 O2的转化率为 。
(3)尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1mol/LNa2SO3溶液,实验测定其pH约为8,完成下列问题:
①该溶液中c(Na+)与 c(OH-)之比为 。
②该溶液中c(OH-)= c(H+)+ + (用溶液中所含微粒的浓度表示)。
③当向该溶液中加入少量NaOH固体时,c(SO32-) ,c(Na+) 。(选填“增大”、“减小”或“不变”)
(4)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是 。
A.Na2CO3 B.Ba(NO3)2 C.Na2S D.酸性KMnO4
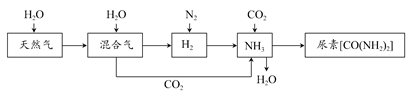
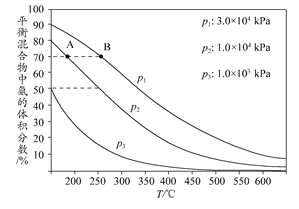

 CH3OH(g)。
CH3OH(g)。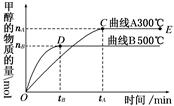
 2NH3 △H<0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为 mol·L-1·min-1。
2NH3 △H<0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为 mol·L-1·min-1。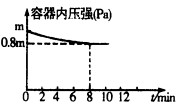

 H=-akJ·mol-1
H=-akJ·mol-1