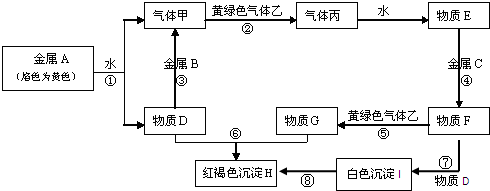
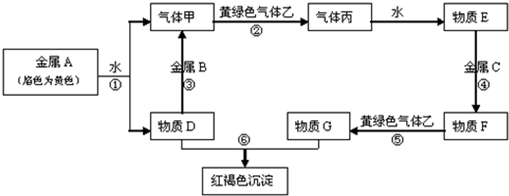
题目内容
它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).
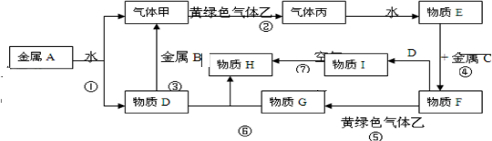
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A______、C______、丙______;
(2)写出反应③的化学方程式______,
写出反应⑤的离子方程式______,
写出反应⑦的化学方程式______;
(3)冶炼金属A、B一般用______法,冶炼金属C一般用______法.
解:黄绿色气体为Cl2,则与Cl2反应的气体甲为H2,丙为HCl,物质E为盐酸,金属A与水反应生成的D可能为碱,也可能为金属氧化物,但D能与金属B反应生成氢气,则D应为碱,为NaOH,所以A为Na,B为Al,盐酸与金属C反应,后还能继续与氯气反应,则金属C为变价金属,应为Fe,所以F为FeCl2,G为FeCl3,I为Fe(OH)2,H为4Fe(OH)3,则
(1)由以上分析可知,A为Na,C为Fe,丙为 HCl,故答案为:Na;Fe; HCl;
(2)反应③为Al和NaOH溶液的反应,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,反应⑤为Cl2和FeCl2的反应,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,Fe(OH)2具有还原性,能与空气中氧气反应生成Fe(OH)3,反应的化学方程式为4Fe(OH)2+2H2O+O2=4Fe(OH)3,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;2Fe2++Cl2=2Fe3++2Cl-;4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(3)Na、Al为活泼金属,应用电解法冶炼,Fe可用热还原法冶炼,故答案为:电解法; 热还原.
分析:黄绿色气体为Cl2,则与Cl2反应的气体甲为H2,丙为HCl,物质E为盐酸,金属A与水反应生成的D可能为碱,也可能为金属氧化物,但D能与金属B反应生成氢气,则D应为碱,为NaOH,所以A为Na,B为Al,盐酸与金属C反应,后还能继续与氯气反应,则金属C为变价金属,应为Fe,所以F为FeCl2,G为FeCl3,I为Fe(OH)2,H为4Fe(OH)3,结合物质的性质解答该题.
点评:本题考查无机物的推断,题目难度中等,注意把握物质之间转化的特点,尤其是物质反应的典型现象,学习中注意相关基础知识的积累.
(1)由以上分析可知,A为Na,C为Fe,丙为 HCl,故答案为:Na;Fe; HCl;
(2)反应③为Al和NaOH溶液的反应,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,反应⑤为Cl2和FeCl2的反应,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,Fe(OH)2具有还原性,能与空气中氧气反应生成Fe(OH)3,反应的化学方程式为4Fe(OH)2+2H2O+O2=4Fe(OH)3,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;2Fe2++Cl2=2Fe3++2Cl-;4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(3)Na、Al为活泼金属,应用电解法冶炼,Fe可用热还原法冶炼,故答案为:电解法; 热还原.
分析:黄绿色气体为Cl2,则与Cl2反应的气体甲为H2,丙为HCl,物质E为盐酸,金属A与水反应生成的D可能为碱,也可能为金属氧化物,但D能与金属B反应生成氢气,则D应为碱,为NaOH,所以A为Na,B为Al,盐酸与金属C反应,后还能继续与氯气反应,则金属C为变价金属,应为Fe,所以F为FeCl2,G为FeCl3,I为Fe(OH)2,H为4Fe(OH)3,结合物质的性质解答该题.
点评:本题考查无机物的推断,题目难度中等,注意把握物质之间转化的特点,尤其是物质反应的典型现象,学习中注意相关基础知识的积累.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目