题目内容
18.常温下,下列有关醋酸的叙述中不正确的是( )| A. | pH=5.6的由CH3COOH与CH3COONa组成的混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | 等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14 | |
| C. | 将pH=a的醋酸稀释为pH=a+1的过程中,c(OH-)不断增大 | |
| D. | 浓度为0.1 mol•L-1的CH3COOH溶液和氨水等体积混合后;c(CH3COO-)+c(OH-)=c(H+)+c(NH4+) |
分析 A、CH3COOH与CH3COONa组成的混合溶液中共存在c(Na+)、c(CH3COO-)、c(H+)、c(OH-)4种离子,据电荷守恒分析;
B、pH=a的醋酸与pH=b的NaOH溶液恰好中和,醋酸和氢氧化钠的物质的量相等;
C、醋酸稀释时,溶液酸性减弱;
D、据电荷守恒分析.
解答 解:A、常温下,CH3COONa与CH3COOH的混合溶液的pH=5.6,则:c(OH?)<c(H+),根据电荷守恒c(CH3COO?)+c(OH?)=c(H+)+c(Na+)可得:c(CH3COO?)>c(Na+),故A正确;
B、pH=a的醋酸与pH=b的NaOH溶液恰好中和,醋酸和氢氧化钠的物质的量相等,如醋酸为强酸时存在a+b=14,但醋酸为弱酸,故B错误;
C、醋酸稀释时,溶液酸性减弱则碱性增强,c(OH-)不断增大,故C正确;
D、浓度为0.1 mol•L-1的CH3COOH溶液和氨水等体积混合后生成醋酸铵,据电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(NH4+),故D正确;
故选B.
点评 本题考查弱电解质的电离,侧重于学生的分析能力的考查,为高考常见题型,注意把握弱电解质的电离特点以及影响因素,难度不大.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
8.“纳米材料”是粒子直径为1-100nm的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到蒸馏水中所形成的物质,下列说法正确的是( )①是溶液②种置后会析出黑色沉淀③能产生丁达尔效应④能透过滤纸⑤不能透过滤纸⑥是胶体.
| A. | ①④⑤ | B. | ③④⑥ | C. | ②③⑤ | D. | ②③⑥ |
9.等体积的下列溶液中,阳离子的总物质的量最大的是 ( )
| A. | 0.2mol•L-1的CuSO4溶液 | B. | 0.1mol•L-1的Na2CO3 | ||
| C. | 0.2mol•L-1的KCl | D. | 0.1mol•L-1的Na2SO4 |
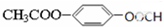
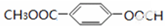
3.如图所示的有机物可发生的反应类型有①取代 ②加成 ③消去 ④氧化( )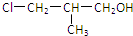
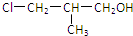
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②④ |
10.对于某些离子的检验及结论一定正确的是( )
| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| B. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| C. | 无色溶液焰色反应呈黄色,结论:试液是钠盐溶液 | |
| D. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
7.已知:①2H2(g)+O2(g)═2H2O (g)△H=-483.6kJ•mol
②H+(aq)+OH-(aq)═H2O(1)△H=-57.3kJ•mol
下列说法中正确的是( )
②H+(aq)+OH-(aq)═H2O(1)△H=-57.3kJ•mol
下列说法中正确的是( )
| A. | 由①式可知H2的燃烧热为241.8kJ/mol | |
| B. | 2H2(g)+O2(g)=2H2O(1)△H>-483.6kJ/mol | |
| C. | 将含1mol NaOH的稀溶液与0.05mol浓硫酸溶液混合后放出的热量为57.3kJ | |
| D. | 将含1molBa(OH)2的稀溶液与含2mol HCl的稀溶液混合后放出的热量等于114.6kJ |
8.CH3-CH=CH-CH2-CH2Cl,该有机物能发生( )
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使KMnO4酸性溶液褪色 ⑥与AgNO3溶液生成白色沉淀 ⑦聚合反应.
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使KMnO4酸性溶液褪色 ⑥与AgNO3溶液生成白色沉淀 ⑦聚合反应.
| A. | 以上反应均可发生 | B. | 只有⑦不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |

 请回答下面问题:
请回答下面问题: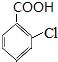 +3NaOH$\stackrel{水}{→}$
+3NaOH$\stackrel{水}{→}$ +NaCl+2H2O
+NaCl+2H2O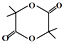
 、
、 .
.