题目内容
用沉淀法测定NaHCO3和K2CO3混合物的组成,实验过程是每次称取一定质量的样品溶于水,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应。实验记录见下表:实验次数 | 样品质量/g | Ba(OH)2溶液体积/L | 生成沉淀质量/g |
1 | 0.858 | 0.5 | 1.379 |
2 | 1.716 | 0.5 |
|
3 | 2.574 | 0.5 | 4.137 |
4 | 3.432 | 0.5 | 5.516 |
5 | 4.290 | 0.5 | 5.516 |
(1)第2次实验中产生沉淀的质量是多少?把结果填写在表格内相应的空格中。??
(2)样品中NaHCO3和K2CO3的物质的量之比是多少?写出计算过程。
(1)2.758?
(2)第1、2、3次实验均为Ba(OH)2过量,选取第1次进行计算。?
设样品中NaHCO3、K2CO3的物质的量分别为x、y。?
84 g·mol-1·x+138 g·mol-1·y=0.858 g?
x +y =1.379 g÷197 g·mol-1??
解得:x =0.002 mol?
y =0.005 mol?
NaHCO3和K2CO3的物质的量之比为2∶5?
解析:(1)应为第一次沉淀1.379 g的两倍即?2.758 g?。?
(2)欲计算NaHCO3和K2CO3的物质的量之比,必须两者不足按两者计算,由生成沉淀看出1、2、3次均为Ba(OH)2过量,均可用于计算。?
设两个未知数代表两者物质的量,则可根据质量和沉淀质量列出两个方程,用方程组求解。
例:按第1次计算设NaHCO3的物质的量为x,K2CO3物质的量为y。?
有: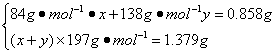
解得:![]()
故n(NaHCO3)∶n(K2CO3)=2∶5

实验次数 | 样品质量/g | 沉淀质量/g |
1 | 1.716 | 2.758 |
2 | 2.574 |
|
3 | 3.432 | 5.516 |
4 | 4.290 | 5.516 |
完成下列问题:
(1)第2次实验中产生沉淀的质量是多少,将结果填入表格空白处。
(2)Ba(OH)2溶液中溶质的物质的量浓度是___________。
(3)第2次实验样品中NaHCO3的物质的量是_________。
(4)室温下取第2组实验所得溶液体积的1/10,加水配成500 mL溶液,求稀释以后溶液的pH。