题目内容
图1为某化学反应的速率与时间的关系示意图。下列有关t1时刻改变条件的说法正确的是( )

A.2SO2(g)+O2(g)
 2SO3(g) ΔH<0,t1时刻升高温度
2SO3(g) ΔH<0,t1时刻升高温度
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
ΔH<0,t1 时刻增大O2浓度
4NO(g)+6H2O(g)
ΔH<0,t1 时刻增大O2浓度
C.H2O(g)+CO(g)  H2(g)+CO2(g)
ΔH>0, t1时刻增大压强
H2(g)+CO2(g)
ΔH>0, t1时刻增大压强
D.C(s)+H2O(g)  CO(g)+H2(g)
ΔH>0,t1时刻升高温度
CO(g)+H2(g)
ΔH>0,t1时刻升高温度
D
【解析】A中反应是放热反应,升高温度平衡向逆反应方向移动,逆反应速率大于正反应速率,A不正确;B中增大氧气浓度,逆反应速率不变,B不正确;C中反应前后体积不变,改变压强,平衡不移动,C不正确;D中反应是吸热反应,升高温度,平衡向正反应方向移动,逆反应速率小于正反应速率,D正确,答案选D。

 发散思维新课堂系列答案
发散思维新课堂系列答案(8分)(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的总能量 (填“>”、“<”或“=”)CO2和NO的总能量。
(2)在某体积为2L的密闭容器中充入0.5mol NO2和1mol CO,在一定条件下发生反应:
NO2+CO CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
①该段时间内,用CO2表示的平均反应速为 。
②假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量为 。
③下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是
| A.容器内气体的质量保持变 | B.NO2的物质的量浓度不再改变 |
| C.容器内气体的平均相对分子质量不变 | D.NO2的消耗速率与CO2的消耗速率相等 |
某课外活动小组利用如下左图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请填写下列空白:
(1)检验乙醛的试剂是 ;
| A.银氨溶液 | B.碳酸氢钠溶液 | C.新制氢氧化铜悬浊液 | D.氧化铜 |
(3)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是 ___ ,由于装置设计上的缺陷,实验进行时可能会 _____ 。
(4)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如上右图所示。
试解释鼓气速度过快,反应体系温度反而下降的原因: ,该实验中“鼓气速度”这一变量你认为可用 来估量;
(5)该课外活动小组偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
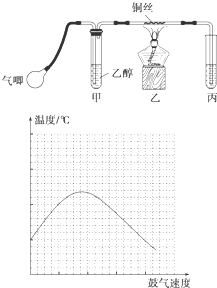 某研究性学习小组的同学利用如图所示装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去.实验时,先加热玻璃管中的铜丝,约1min后鼓入空气.
某研究性学习小组的同学利用如图所示装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去.实验时,先加热玻璃管中的铜丝,约1min后鼓入空气.
 CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则: