题目内容
铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:
(1)铝的原子结构示意图为___________;铁、铝、铜三种金属的金属活动性由弱到强的排列顺序是__________。
(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式:_________________。
(3)如图装置中,铁作________极,铜电极的电极反应式为_________________________。
(4)已知铜与稀硫酸不反应,但铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示其原因:__________________________________________________________。
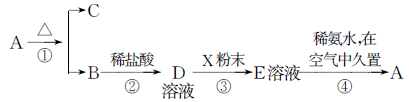
(5)氯化铝广泛用作有机合成和石油工业的催化剂。将铝土矿粉(主要成分为A12O3)与焦炭混合后加热并通人氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式:_____________________________ ,该反应的氧化剂是_________________。
(6)某校兴趣小组为测定一种铁铝硅合金 (FexAlySiz) 粉末的组成,提出如下方案:准确称取1.46 g该合金粉末,加入过量盐酸溶液,充分反应后过滤,测定剩余固体质量0.07 g。向滤液中滴加足量NaOH浓溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧,得红棕色粉末1.60g,通过计算确定此合金的组成为________________ (填化学式)。
(1) ;铜<铁<铝(或Cu<Fe<Al)(2)2Fe3++Cu=2Fe2++Cu2+(3)负;Cu2++2e-=Cu(4)2Cu+O2+2H2SO4
;铜<铁<铝(或Cu<Fe<Al)(2)2Fe3++Cu=2Fe2++Cu2+(3)负;Cu2++2e-=Cu(4)2Cu+O2+2H2SO4 2CuSO4+2H2O(5)Al2O3+3Cl2+3C
2CuSO4+2H2O(5)Al2O3+3Cl2+3C 2AlCl3+3CO;Cl2(6)Fe8Al4Si
2AlCl3+3CO;Cl2(6)Fe8Al4Si
解析试题分析:(1)铝的原子序数13,最外层3个电子,结构示意图 ;金属活动性顺序是:K、Ca、Na、Mg、Al、Mn、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au,利用此表的信息,结合活动性前大于后,则铜<铁<铝(或Cu<Fe<Al)(2)Cu与FeCl3溶液反应生成氯化铜和氯化亚铁,离子反应为Cu+2Fe3+=2Fe2++Cu2+(3)该装置能自发的进行氧化还原反应而构成原电池,铁的金属活性大于铜,即铁易失电子而作负极,负极上失电子发生氧化反应,铜极得电子发生还原反应,铜电极反应式Cu2++2e-=Cu(4)因溶液中有氧气,加热能与铜反应生成氧化铜:2Cu+O2
;金属活动性顺序是:K、Ca、Na、Mg、Al、Mn、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au,利用此表的信息,结合活动性前大于后,则铜<铁<铝(或Cu<Fe<Al)(2)Cu与FeCl3溶液反应生成氯化铜和氯化亚铁,离子反应为Cu+2Fe3+=2Fe2++Cu2+(3)该装置能自发的进行氧化还原反应而构成原电池,铁的金属活性大于铜,即铁易失电子而作负极,负极上失电子发生氧化反应,铜极得电子发生还原反应,铜电极反应式Cu2++2e-=Cu(4)因溶液中有氧气,加热能与铜反应生成氧化铜:2Cu+O2 2CuO,氧化铜再与硫酸反应:CuO+H2SO4=CuSO4+H2O,两式相加:2Cu+O2+2H2SO4
2CuO,氧化铜再与硫酸反应:CuO+H2SO4=CuSO4+H2O,两式相加:2Cu+O2+2H2SO4 2CuSO4+2H2O(5)根据题意知,反应物是氧化铝、碳和氯气,反应条件是加热,生成物是氯化铝和一氧化碳,所以其反应方程式为Al2O3+3Cl2+3C
2CuSO4+2H2O(5)根据题意知,反应物是氧化铝、碳和氯气,反应条件是加热,生成物是氯化铝和一氧化碳,所以其反应方程式为Al2O3+3Cl2+3C 2AlCl3+3CO;氧化剂发生还原反应化合价降低,其中氯气化合价由0降至-1价的氯离子,故Cl2为氧化剂(6)由题意知,合金中主要成分为铁、铝、硅,铝在过量盐酸中生成铝离子,铁和盐酸反应生成亚铁离子,而硅不与盐酸反应,即有硅0.07g,又在滤液中加入碱后生成1.6g红棕色粉末为氧化铁,即合金中有铁1.12g,原质量为1.46g,则铝0.27g,铁:铝:硅的物质的量比为8:4:1,故FexAlySiz为Fe8Al4Si
2AlCl3+3CO;氧化剂发生还原反应化合价降低,其中氯气化合价由0降至-1价的氯离子,故Cl2为氧化剂(6)由题意知,合金中主要成分为铁、铝、硅,铝在过量盐酸中生成铝离子,铁和盐酸反应生成亚铁离子,而硅不与盐酸反应,即有硅0.07g,又在滤液中加入碱后生成1.6g红棕色粉末为氧化铁,即合金中有铁1.12g,原质量为1.46g,则铝0.27g,铁:铝:硅的物质的量比为8:4:1,故FexAlySiz为Fe8Al4Si
考点:原电池和电解池的工作原理;化学反应方程式的书写;

 一本好题口算题卡系列答案
一本好题口算题卡系列答案纯碱、烧碱等是重要的化工原料。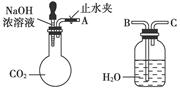
(1)利用上图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是 ,若其他操作不变,将A与C连接,可观察到的现象是 。
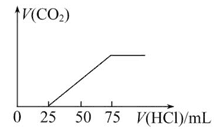
(2)向NaOH溶液中通入一定量CO2,结晶后得到白色固体,该白色固体的组成可能是
| A.NaOH和Na2CO3; | |
| B.; | |
| C.; | D.。 |
| 实验操作 | 实验现象 | 结论 |
| (1)取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | | |
| (2) | | |

 mol/L。
mol/L。