题目内容
二元弱酸是分步电离的,25时碳酸和草酸的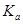 如下表:
如下表:
(1)设有下列四种溶液:
A.0.1 mol/L的Na2C2O4溶液 B.0.1 mol/L的NaHC2O4溶液
C.0.1 mol/L的Na2CO3溶液 D.0.1 mol/L的NaHCO3溶液
其中,c(H+)最大的是_________,c(OH-)最大的是_________ 。
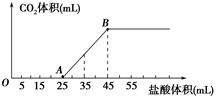
(2)某化学实验兴趣小组同学向用大理石和稀盐酸制备CO2后残留液中滴加碳酸钠溶液,在溶液中插人pH传感器,测得pH变化曲线如图所示。
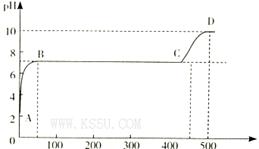
刚开始滴人碳酸钠溶液时发生反应的离子方程式为_________,BC段发生反应的离子方程式为_____,D点时混合溶液中由水电离产生的c(H+)="_________" mol/L。
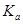 如下表:
如下表: | H2CO3 | Ka1=4.3×10-7 | H2C2O4 | Ka1=5.6×10-2 |
| Ka2=5.6×10-11 | Ka2=5.42×10-5 |
(1)设有下列四种溶液:
A.0.1 mol/L的Na2C2O4溶液 B.0.1 mol/L的NaHC2O4溶液
C.0.1 mol/L的Na2CO3溶液 D.0.1 mol/L的NaHCO3溶液
其中,c(H+)最大的是_________,c(OH-)最大的是_________ 。
(2)某化学实验兴趣小组同学向用大理石和稀盐酸制备CO2后残留液中滴加碳酸钠溶液,在溶液中插人pH传感器,测得pH变化曲线如图所示。

刚开始滴人碳酸钠溶液时发生反应的离子方程式为_________,BC段发生反应的离子方程式为_____,D点时混合溶液中由水电离产生的c(H+)="_________" mol/L。
(1)B C (2)2H++CO32-=H2O+CO2↑ Ca2++CO32-=CaCO3↓ 10-4
试题分析:(1)因为H2C2O4的二级电离平衡常数Ka2=5.42×10-5> H2CO3的二级电离平衡常数Ka2=5.6×10-11。所以在这四种溶液c(H+)最大的是0.1 mol/L的NaHC2O4溶液。正确选项为B.电离平衡常数越小,其钠盐水解的程度就越大。溶液的碱性就越强。由于Ka2(H2C2O4)=5.42×10-5> 5.6×10-11= Ka2(H2CO3),所以c(OH-)最大的是0.1 mol/L的Na2CO3溶液。正确选项为C.(2)在反应开始时由于溶液的pH略大于2,说明溶液中含有过量稀盐酸电离产生大量的H+。此时滴入碳酸钠溶液时发生反应的离子方程式为2H++CO32-=H2O+CO2↑;在PH=7,溶液呈中性时发生的反应为CaCl2+Na2CO3="2NaCl+" CaCO3↓.反应的离子方程式为Ca2++CO32-=CaCO3↓。当该反应发生完全后继续加入Na2CO3,则是Na2CO3和NaCl的混合溶液。NaCl是强酸强碱盐,不发生水解反应,而Na2CO3是强碱弱酸盐,弱酸根离子发生水解反应,消耗水电离产生的H+,使溶液显碱性。在D点溶液的pH=10,则c(H+)=10-10mol/L.由于H+you 消耗,所以水电离产生的OH-的浓度为:c(OH-)=Kw÷c(H+)=10-4mol/L.所以c(H+)(水)= c(OH-)(水)= 10-4mol/L。+)、c(OH-)\的比较及混合溶液中离子方程式的书写及盐水解时水电离产生的离子浓度的问题。

练习册系列答案
相关题目