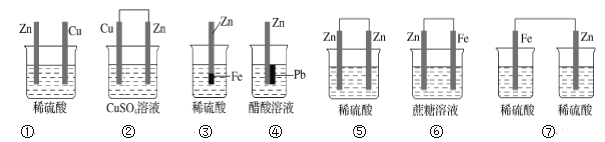
题目内容
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。下图是元素周期表的一部分,回答下列问题:
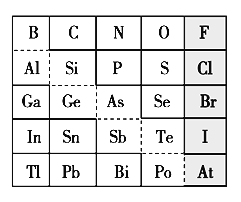
(1)元素Ga在元素周期表中的位置为:______________。
(2)Sn的最高正价为________,Cl的最高价氧化物对应水化物的化学式为________,Bi的最高价氧化物的化学式为________。
(3)根据元素周期律,推断:
①阴影部分元素形成的氢化物中沸点最高的是________。
②H3AsO4、H2SeO4的酸性强弱为:H3AsO4________H2SeO4(填“>”、“<”、“=”或“无法比较”)。
③氢化物的还原性:H2O________H2S(填“>”、“<”、“=”或“无法比较”)。
④原子半径比较:N________Si(填“>”、“<”、“=”或“无法比较”)。
(4)可在图中分界线(虚线部分)附近寻找________(填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)若比较C、Si的非金属性强弱,请从下列试剂中选择最佳试剂组合进行实验, 请写出实验过程:(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液) _______________。
【答案】第四周期 ⅢA族 +4 HClO4 Bi2O5 HF < < < B 在试管中加入CaCO3固体,再加入盐酸,将生成气体通过饱和NaHCO3溶液洗气后,通入Na2SiO3溶液;生成白色胶状沉淀,则碳酸酸性强于硅酸,即C的非金属性强于Si
【解析】
(1)元素Ga和B、Al在同一主族,并且在Al元素的下一个周期,所以Ga在周期表中的位置为:第四周期 ⅢA族。答案:第四周期 ⅢA族。
(2)由表知Sn和C在同一主族,所以最高正价为+4;Cl位于VIIA,最高化合价为+7价,Cl最高价氧化物对应水化物的化学式为HClO4;Bi位于VA,最高化合价为+5价,最高价氧化物的化学式为Bi2O5。答案:Bi2O5。
(3)①阴影部分元素包括F、Cl、Br、I,属于同一主族。因为HF分子间存在着氢键,形成的氢化物中沸点最高的是HF。答案:HF。
②因为非金属性As<Se,所以酸性H3AsO4<H2SeO4,答案:<。
③因为非金属性S<O,所以氢化物的还原性:H2O<H2S。答案:< 。
④因为原子半径N<P,P< Si,所以N< Si。答案:<。
(4)图中虚线部分为金属和非金属分界线,可以在附近寻找半导体材料。答案:B。
(5) C、Si的非金属性强弱顺序为C>Si,可以根据碳酸酸性强于硅酸来证明,化学反应中,强酸可以制得弱酸,即在试管中加入CaCO3固体,再加入盐酸,将生成气体通过饱和NaHCO3溶液洗气后,通入Na2SiO3溶液,生成白色胶状沉淀,则碳酸酸性强于硅酸,结论:非金属性C>Si。因此,本题正确答案是:在试管中加入CaCO3固体,再加入盐酸,将生成气体通过饱和NaHCO3溶液洗气后,通入Na2SiO3溶液;生成白色胶状沉淀,则碳酸酸性强于硅酸,即C的非金属性强于Si。