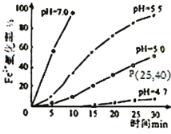
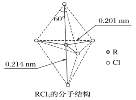
题目内容
【题目】已知非金属元素A、B、C、D、E均属于短周期元素,其原子序数依次增大,A元素原子形成的离子核外电子数为零,B原子的最外层电子数是内层电子数的2倍,通常状况下E的单质是黄色晶体,不溶于水,易溶于二硫化碳,D与E在同一主族,C、D在周期表中处于相邻的位置,请回答下列问题:
(1)A元素的名称是________,E的阴离子结构示意图是__________________。
(2)元素C的最高价氧化物对应水化物与其气态氢化物反应生成化合物Z,该反应的离子方程式为____________________________________________,化合物Z属于________________(填“离子化合物”或“共价化合物”),Z中含有的化学键类型是________________。
(3)C元素的最高价氧化物对应的水化物的稀溶液能与D、E元素形成的一种化合物发生氧化还原反应,其离子反应方程式为__________________________。
【答案】氢 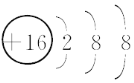 NH3+H+=NH4+ 离子化合物 离子键、共价键 3SO2+2H2O+2NO3- = 3SO42-+2NO+4H+
NH3+H+=NH4+ 离子化合物 离子键、共价键 3SO2+2H2O+2NO3- = 3SO42-+2NO+4H+
【解析】
非金属元素A、B、C、D、E均属于短周期元素,其原子序数依次增大,A元素原子形成的离子核外电子数为零,则A为H;B原子的最外层电子数是内层电子数的2倍,有2个电子层时,则B为C;通常状况下E的单质是黄色晶体,易溶于二硫化碳,则E为S;D与E在同一主族,A、B、C、D、E的原子序数依次增大,则D为O;C、D在周期表中处于相邻的位置,则C为N,据此解答。
分析知:A为H、B为C、C为N、D为O、E为S;
(1)A元素的名称是氢,E为S元素,S2-结构示意图是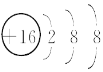 ;
;
(2)元素C为N ,其最高价氧化物对应水化物为HNO3,其气态氢化物为NH3,两者反应生成NH4NO3,发生反应的离子方程式为NH3+H+=NH4+,NH4NO3属于离子化合物,含有的化学键类型是离子键、共价键;
(3) 元素C为N ,其最高价氧化物对应水化物为HNO3,D、E元素形成的一种化合物有SO2和SO3,其中SO2能被稀硝酸氧化生成硫酸,同时生成的还原产物为NO,则发生反应的离子反应方程式3SO2+2H2O+2NO3- = 3SO42-+2NO+4H+。

【题目】高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂。以废铁屑(含有少量Ni)为主要原料制备高铁酸钾的流程如下:
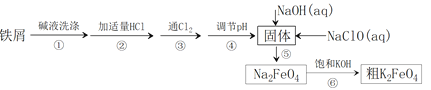
资料显示:一些金属氢氧化物开始沉淀和完全沉淀的pH如下:
M(OH)n | pH | |
开始沉淀 | 沉淀完全 | |
Fe(OH)3 | 2.53 | 2.94 |
Ni(OH)2 | 7.60 | 9.75 |
(1)高铁酸钾具有高效消毒主要是因其具有__________性所致。
(2)步骤③反应的离子方程式是_______。
(3)步骤④不能引入新杂质,调节pH所用的某种氧化物的化学式是___________,调节pH的范围是__________________。
(4)步骤⑤发生反应的离子方程式是________。
(5)该流程中可循环利用的物质是:_______(写化学式)。
(6)步骤⑥中,由Na2FeO4 得到粗K2FeO4的原理可能是___________。
(7)测定产品纯度:将wg粗产品,溶入过量的碱性亚铬酸盐溶液中,充分反应后,加入稀硫酸酸化至pH为2,在所得的重铬酸盐溶液中加入5滴二苯胺磺酸钠溶液作指示剂,然后用c mol·L1 (NH4)2Fe(SO4)2溶液滴定至终点,消耗滴定液V mL。有关滴定反应有:
Cr(OH)4-+FeO42-+3H2O![]() Fe(OH)3·3H2O↓+CrO42- +OH
Fe(OH)3·3H2O↓+CrO42- +OH
2![]() +2H
+2H![]()
![]() +H2O
+H2O
![]() +6Fe2++14H
+6Fe2++14H![]() 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
该粗产品中K2FeO4的纯度为____________(用含w、c、V的代数式表示)。若滴定管没有用待装液润洗,则测得结果________(“偏高”“偏低”或“无影响”)。