题目内容
【题目】表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用元素符号或化学式等化学用语回答下列问题: 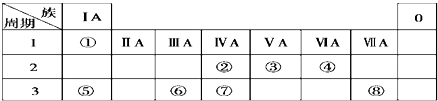
(1)元素①的名称是 .
(2)元素②、⑥、⑦的原子半径由大到小的顺序是(用元素符号表示).
(3)写出元素③的最高价氧化物的化学式: .
(4)用电子式表示出元素⑤与⑧形成化合物的过程: .
(5)元素②的最高正价是 , 它与元素④按照原子个数比为1:2形成的化合物的结构式是 , 该化合物是(离子、共价)化合物.
【答案】
(1)氢
(2)Al>Si>C
(3)N2O5
(4)![]()
(5)+4;O=C=O;共价
【解析】解:由元素在周期表中位置,可知①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl.(1)元素①的名称是氢,所以答案是:氢;(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Al>Si>C,所以答案是:Al>Si>C;(3)元素③的最高价氧化物为N2O5 , 所以答案是:N2O5;(4)⑤与⑧形成化合物NaCl,由钠离子与氯离子构成,用电子式表示形成过程为: ![]() ,所以答案是:
,所以答案是: ![]() ;(5)主族元素最高正化合价等于主族族序数,元素②的最高正化合价为+4,元素②与元素④按照原子个数比为1:2形成的化合物为CO2 , 分子中碳原子与氧原子之间形成2对共用电子对,结构式为O=C=O,属于共价化合物,所以答案是:+4;O=C=O;共价.
;(5)主族元素最高正化合价等于主族族序数,元素②的最高正化合价为+4,元素②与元素④按照原子个数比为1:2形成的化合物为CO2 , 分子中碳原子与氧原子之间形成2对共用电子对,结构式为O=C=O,属于共价化合物,所以答案是:+4;O=C=O;共价.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目