题目内容
【题目】用中和滴定法测定烧碱纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3 g烧碱样品配成250 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有______________________。
(2)取10.00 mL待测液,用_____________式滴定管量取。
(3)用0.200 0 mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视_____________,直到滴定终点。
(4)根据下列数据,烧碱的纯度为_____________(以百分数表示,小数点后保留两位)。
滴定次数 | 待测体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(5)以标准的盐酸滴定未知浓度的氢氧化钠溶液为例,判断下列操作引起的误差(填“偏大”“偏小”“无影响”或“无法判断”)
①读数:滴定前平视,滴定后俯视_____________;
②用待测液润洗锥形瓶_____________;
③滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁__________________________。
【答案】250 mL容量瓶、胶头滴管、天平 碱 锥形瓶内溶液颜色变化 93.02% 偏小 偏大 无影响
【解析】
(1)依据一定体积物质的量浓度溶液配制时的操作步骤所需的仪器作答;
(2)待测液为氢氧化钠,显碱性;
(3)依据正确的操作步骤作答;
(4)先计算出标准盐酸的体积,依据 c(测) = 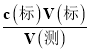 ,最后计算出烧碱的质量,得出纯度;
,最后计算出烧碱的质量,得出纯度;
(5)依据操作不当对标准溶液体积的影响判断误差,结合c(测) = 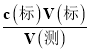 来分析对测定结果的影响;
来分析对测定结果的影响;
(1)配成250mL的待测液,需要的仪器除小烧杯、量筒、玻璃棒外,还有250mL容量瓶,胶头滴管、天平等;
(2)氢氧化钠溶液显碱性,所以取10.00mL待测液,应该用碱式滴定管来量取,故答案为:碱;
(3)用0.2000mol/L标准盐酸溶液滴定待测烧碱溶液,滴定时左手控制活塞,右手不停地振荡锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到滴定终点,故答案为:锥形瓶内溶液颜色变化;
(4)根据表中数据可知,两次实验中消耗盐酸的体积是20.40 mL -0.50 mL =19.90mL、24.10 mL -4.00 mL =20.10mL,则消耗盐酸体积的平均值是![]() =20.00 mL,则待测烧碱溶液的浓度是
=20.00 mL,则待测烧碱溶液的浓度是![]() =0.4000mol/L,故样品中m(NaOH)=0.4000mol/L×0.250L×40g/mol=4.0g,则烧碱的纯度为:
=0.4000mol/L,故样品中m(NaOH)=0.4000mol/L×0.250L×40g/mol=4.0g,则烧碱的纯度为:![]() ×100%=93.02%;
×100%=93.02%;
(5)①读数:滴定前平视,滴定后俯视,会导致标准溶液的体积偏小,最后使测定的氢氧化钠的浓度偏小,导致最终结果偏小;
②用待测液润洗锥形瓶,会使待测液浓度偏大,消耗的标准液的体积偏大,最后使测定的氢氧化钠的浓度偏大,导致最终结果偏大;
③滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁,对待测液的物质的量无影响,测定的浓度无影响,因此最后对最终结果也无影响。