题目内容
摩尔盐[(NH4)2SO4?FeSO4?6H2O]是一种复盐,它易溶于水,不溶于乙醇,性质比一般亚铁盐稳定,不易被氧化.某实验小组查得硫酸铵、七水硫酸亚铁、硫酸亚铁铵的溶解度如下表:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| (NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
| FeSO4?7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | - |
| (NH4)2SO4?FeSO4?6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
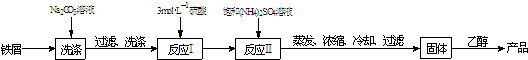
(1)为了加快铁屑的溶解,可加入少量的______(填物质名称).
(2)反应Ⅰ进行后要“趁热过滤”,其目的是:______.实验中要在反应Ⅱ的溶液中加入少量稀硫酸,其作用是:______.
(3)反应Ⅱ后的溶液经蒸发等操作所得固体用乙醇洗涤的目的是:______.
(4)在摩尔盐溶液中加入足量氨水,反应的离子方程式为:______.
解:(1)可以加入Cu或CuSO4,铁和铜在溶液中形成原电池,铁做负极失电子发生氧化反应,加快反应速率,故答案为:铜或硫酸铜等;
(2)反应后Ⅰ要“趁热过滤”,防止温度降低析出FeSO4?7H2O造成FeSO4的损失,除去过量铁屑;NH4+、Fe2+水解呈酸性,加入少量硫酸抑制Fe2+、NH4+的水解,
故答案为:除去过量铁屑;防止温度降低析出FeSO4?7H2O造成FeSO4的损失;抑制Fe2+、NH4+的水解;
(3)除去晶体表面的少量水分和其它可溶性杂质,避免水洗时晶体溶解损失,故答案为:除去晶体表面的少量水分;
(4)摩尔盐溶液中加入足量氨水,Fe2+与NH3?H2O生成Fe(OH)2与NH4+,反应离子方程式为Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+,
故答案为:Fe2++2(NH3?H2O)=Fe(OH)2↓+2NH4+.
分析:(1)可以加入Cu或CuSO4,形成原电池,加快反应速率.
(2)由表中信息可知,温度越低硫酸亚铁的溶解度越小,溶液趁热过滤防止溶液冷却时,硫酸亚铁因析出而损失.NH4+、Fe2+水解呈酸性,加入少量硫酸抑制Fe2+、NH4+的水解;
(3)硫酸亚铁铵几乎不溶于乙醇,为防止硫酸亚铁铵损失,不用水洗;
(4)Fe2+与NH3?H2O生成Fe(OH)2与NH4+.
点评:本题以莫尔盐的制备为载体,考查化学用语、原电池、物质分离提纯等有关实验操作以及综合运用知识解决问题的能力,题目难度中等.注意基础知识的全面掌握.
(2)反应后Ⅰ要“趁热过滤”,防止温度降低析出FeSO4?7H2O造成FeSO4的损失,除去过量铁屑;NH4+、Fe2+水解呈酸性,加入少量硫酸抑制Fe2+、NH4+的水解,
故答案为:除去过量铁屑;防止温度降低析出FeSO4?7H2O造成FeSO4的损失;抑制Fe2+、NH4+的水解;
(3)除去晶体表面的少量水分和其它可溶性杂质,避免水洗时晶体溶解损失,故答案为:除去晶体表面的少量水分;
(4)摩尔盐溶液中加入足量氨水,Fe2+与NH3?H2O生成Fe(OH)2与NH4+,反应离子方程式为Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+,
故答案为:Fe2++2(NH3?H2O)=Fe(OH)2↓+2NH4+.
分析:(1)可以加入Cu或CuSO4,形成原电池,加快反应速率.
(2)由表中信息可知,温度越低硫酸亚铁的溶解度越小,溶液趁热过滤防止溶液冷却时,硫酸亚铁因析出而损失.NH4+、Fe2+水解呈酸性,加入少量硫酸抑制Fe2+、NH4+的水解;
(3)硫酸亚铁铵几乎不溶于乙醇,为防止硫酸亚铁铵损失,不用水洗;
(4)Fe2+与NH3?H2O生成Fe(OH)2与NH4+.
点评:本题以莫尔盐的制备为载体,考查化学用语、原电池、物质分离提纯等有关实验操作以及综合运用知识解决问题的能力,题目难度中等.注意基础知识的全面掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目