题目内容
测定有机物中碳和氢等元素的含量,最常用的方法是燃烧分析法。即把已知量的样品置于氧气流中,用氧化铜作催化剂,在760℃左右,样品全部被氧化为二氧化碳和水。实验装置如下图所示:
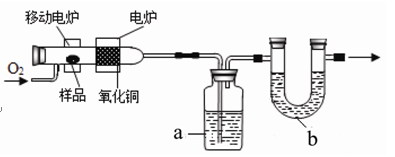
(1)实验时,装置a、b中通常装入的物质分别是 、 。
(2)开始加热之前,要通一段时间的氧气,目的是 ;停止加热后,也要通一段时间的氧气,目的是 。
(3)某次实验中,取用样品烃的含氧衍生物A的质量为2.3g,经测定a装置增重2.7g,b装置增重4.4g。请推算出A物质的实验式: (要求写出计算过程)
(4)经进一步测定得知A的相对分子质量为46,则A的分子式为 。
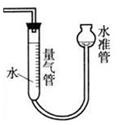
(5)实验发现A物质遇金属钠可以放出氢气,则A物质中具有的官能团为 。同样取2.3g的A,与足量的钠反应,用如图所示装置量取放出的氢气。量取气体时操作水准管的注意事项为 。将量取的气体换算成标准状况体积为cmL,则一个A分子中有 个氢原子被置换了(用含c的表达式表示)。

(1)实验时,装置a、b中通常装入的物质分别是 、 。
(2)开始加热之前,要通一段时间的氧气,目的是 ;停止加热后,也要通一段时间的氧气,目的是 。
(3)某次实验中,取用样品烃的含氧衍生物A的质量为2.3g,经测定a装置增重2.7g,b装置增重4.4g。请推算出A物质的实验式: (要求写出计算过程)
(4)经进一步测定得知A的相对分子质量为46,则A的分子式为 。
(5)实验发现A物质遇金属钠可以放出氢气,则A物质中具有的官能团为 。同样取2.3g的A,与足量的钠反应,用如图所示装置量取放出的氢气。量取气体时操作水准管的注意事项为 。将量取的气体换算成标准状况体积为cmL,则一个A分子中有 个氢原子被置换了(用含c的表达式表示)。

(1)浓硫酸 碱石灰 (各1分)
(2)排出装置中的二氧化碳和水蒸气等 将燃烧生成的二氧化碳和水蒸气彻底排出 (各2分)
(3)C2H6O (过程略)(2分。不带推算过程扣1分)
(4)C2H6O (2分)
(5)羟基(1分) 使其中水的液面与量气管中水的液面相平(2分)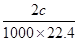 ÷
÷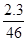 (2分)
(2分)
(2)排出装置中的二氧化碳和水蒸气等 将燃烧生成的二氧化碳和水蒸气彻底排出 (各2分)
(3)C2H6O (过程略)(2分。不带推算过程扣1分)
(4)C2H6O (2分)
(5)羟基(1分) 使其中水的液面与量气管中水的液面相平(2分)
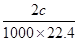 ÷
÷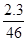 (2分)
(2分)试题分析:(1)这两个装置分别是用来听取收二氧化碳和水的,U形管中只能装固态的物质,所以装置a、b中通常装入的物质分别是:浓硫酸 碱石灰
(2)因为装置中原来的二氧化碳和水影响实验结果,开始加热之前,要通一段时间的氧气,目的是排出装置中的二氧化碳和水蒸气等;反应完成后,停止加热,也要通一段时间的氧气,目的是将燃烧生成的二氧化碳和水蒸气彻底排出,以便被浓硫酸和碱石灰全部吸收,使测定结果准确。
(3)a装置增重2.7g的是水,物质的量为0.15 mol ;b装置增重4.4g是二氧化碳,物质的量为0.1mol。m(C)=1.2g m(H)=0.3g 因此一定含有氧元素。且氧元素质量为:m(O)=2.3-1.2-0.3=0.8g
n(O)=0.05mol
N(C)︰N(H)︰N(O)=0.1︰0.3︰0.05=2:6:1
所以实验式为:C2H6O;
(4)通过相对分子质量可以确定其分子式为:C2H6O (2分)
(5)氢原子数在这个分子式中已达到饱和,其中的氧只能形成羟基;为了使测得的气体体积准确,要使温度和压强恢复到原来的状态,所以使其中水的液面与量气管中水的液面相平,以确保压强和原来保持一致。
氢气中所含有的氢原子为:
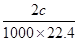 mol,2.3g试样的物质的量就是其中所含氢原子物质的量为:
mol,2.3g试样的物质的量就是其中所含氢原子物质的量为: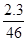 mol
mol则一个A分子中有
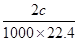 ÷
÷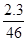 个氢原子被置换了
个氢原子被置换了
练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目