题目内容
(6分)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
(1)锌片上发生的电极反应:______________;银片上发生的电极反应:_____________。
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况);②通过导线的电量。(已知NA = 6.02×1023/mol,一个电子的电量为1.60×10-19 C)
(1)负:Zn-2e-=Zn2+;正:2H++2e-=H2↑
(2)①4.48L ②3.85×104C
解析:该电池为Zn------H2SO4-----Ag 其中锌为负极银为正极。
负:Zn -----2e-= Zn2+;正:2H+ + 2e-= H2↑质量减轻的为溶解的锌
0.2mol 0.4mol 0.4mol 0.2mol
VH2==0.2mol×22.4L/mol==4.48L
Q=0.4mol×6.02×1023 /mol×1.60×10-19C=3.85×104C

练习册系列答案
相关题目
工业制硫酸铜不是直接用铜和浓硫酸反应,而是将粗铜(含少量银)浸入稀硫酸中,并不断从容器下部吹入细小的空气泡.有关该制备方法的叙述中,不正确的是( )
| A、该方法应用了原电池工作原理 | B、该方法不产生污染大气的二氧化硫 | C、该方法提高了硫酸的利用率 | D、该方法提高了铜的利用率 |
|
下图是锌片和铜片同时插入稀硫酸中所组成的原电池装置,c、d为两个电极.则下列有关判断正确的是
| |
A. |
d为正极,发生氧化反应 |
B. |
c为铜片,铜片上发生还原反应 |
C. |
电池工作的过程中,d电极上产生大量的气泡 |
D. |
电池工作的过程中,溶液中 |
如图是锌片和铜片同时插入稀硫酸中所组成的原电池装置,c、d为两个电极。则下列有关的判断不正确的是( )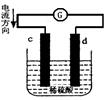
| A.d为负极,发生氧化反应 |
| B.c为锌片,电池工作时,溶液中SO42-向c移动 |
| C.电池工作的过程中,d电极上产生大量的气泡 |
| D.电池工作的过程中,溶液中SO42-浓度基本不变 |

