题目内容
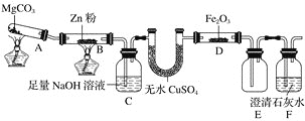
【题目】KIO3为白色结晶粉末,工业上可用电解法制备,装置如图所示,配制碱性电解质溶液(KOH+I2)时,I2发生氧化还原反应,生成KIO3和KI。下列说法错误的是

A.电解时b为阴极
B.电解过程中阴极区溶液pH降低
C.电解过程中K+由左向右通过阳离子交换膜
D.a极反应式为:I--6e-+6OH=IO3-+3H2O
【答案】B
【解析】
根据电解装置图可知,阳离子交换膜可使阳离子通过,b电极得到氢氧化钾溶液,说明溶液中氢离子得到电子发生还原反应,b为电解池的阴极,电极反应为2H2O+2e-=H2↑+2OH-,则a为电解池的阳极,电极反应为I--6e-+6OH=IO3-+3H2O,据此分析解答问题。
A.根据上述分析可知,b为电解池阴极,A选项正确;
B.电解过程中阴极区溶液中OH-离子浓度增大,pH升高,B选项错误;
C.电解过程中K+由左向右通过阳离子交换膜移向阴极,C选项正确;
D.a为电解池的阳极,电极反应为I--6e-+6OH=IO3-+3H2O,D选项正确;
答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目