题目内容
14.某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO和H2O.已知水是反应产物之一.(1)该反应中的还原剂是H2S.
(2)该反应中的还原产物是NO.
(3)写出该反应的化学方程式并标出电子转移的方向和数目:
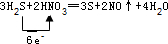 .
.(4)若反应过程中转移了0.3mol电子,则生成水的质量是3.6g.
(5)其中氧化剂和氧化产物的氧化性由强到弱顺序为HNO3>S.
分析 硝酸的氧化性大于硫,所以在该反应中硝酸作氧化剂,在反应中得电子化合价降低,则硫化氢在反应中失电子作还原剂,该反应方程式为3H2S+2HNO3═3S+2NO↑+4H2O,结合化合价变化计算解答.
解答 解:5种物质发生3H2S+2HNO3═3S+2NO↑+4H2O,
(1)S元素的化合价升高,则H2S为还原剂,故答案为:H2S;
(2)N元素的化合价降低,得到电子被还原,则还原产物为NO,故答案为:NO;
(3)S失去电子,N得到电子,该反应中转移6e-,电子转移的方向和数目为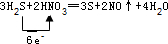 ,故答案为:
,故答案为: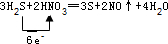 ;
;
(4)转移6mol电子生成4mol水,则转移了0.3mol电子,则生成水的质量是0.3mol×$\frac{4}{6}$×18g/mol=3.6g,故答案为:3.6g;
(5)反应中HNO3为氧化剂,S为氧化产物,氧化剂氧化性大于氧化产物的氧化性,即HNO3>S,故答案为:HNO3>S.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及计算的考查,注意硝酸、硫化氢的性质,题目难度不大.

练习册系列答案
相关题目
20.由两种短周期元素X和Y可组成化合物XY3,当X的原子序数为m时,Y的原子序数可能为( )
①m+4 ②m-8 ③m+2 ④m-6 ⑤m-14 ⑥m+12.
①m+4 ②m-8 ③m+2 ④m-6 ⑤m-14 ⑥m+12.
| A. | ①②③ | B. | ①④⑤⑥ | C. | ①③④⑤⑥ | D. | ①②③④⑤⑥ |
5.下列反应的离子方程式正确的是( )
| A. | 碳酸氢钙溶液加到醋酸中:Ca(HCO3)2+2CH3COOH═Ca2++2CH3COO-+2CO2↑+2H2O | |
| B. | 向AgNO3溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| C. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
2.下列分子结构中,所有原子的最外层满足8电子稳定结构的是( )
| A. | SO2 | B. | PCl5 | C. | NH3 | D. | CS2 |
9.下列说法中正确的是( )
| A. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大 | |
| B. | 用湿润碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 用Ca(OH)2鉴别NaHCO3溶液和饱和Na2CO3溶液 | |
| D. | 把100mL 3mol/L的硫酸与100mL H2O混合,硫酸的物质的量浓度变为1.5mol/L |
19.若1mol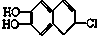 分别与溴水、氢气和NaOH溶液完全反应,最多消耗Br2、氢气和NaOH的物质的量分别是( )
分别与溴水、氢气和NaOH溶液完全反应,最多消耗Br2、氢气和NaOH的物质的量分别是( )
 分别与溴水、氢气和NaOH溶液完全反应,最多消耗Br2、氢气和NaOH的物质的量分别是( )
分别与溴水、氢气和NaOH溶液完全反应,最多消耗Br2、氢气和NaOH的物质的量分别是( )| A. | 2mol、4mol、2mol | B. | 2mol、3mol、3mol | C. | 3mol、2mol、2mol | D. | 3mol、4mol、3mol |
3.在一密闭容器中充入某气态烃和足量的氧气,用电火花点燃完全燃烧后,容器内气体体积保持不变,若气体体积均在120℃和相同的压强下测定的,则该气态烃不可能是( )
| A. | CH4 | B. | C2H6 | C. | C2H4 | D. | C3H4 |
4.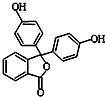 酚酞含片是一种治疗消化系统疾病的药物,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
酚酞含片是一种治疗消化系统疾病的药物,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
 酚酞含片是一种治疗消化系统疾病的药物,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
酚酞含片是一种治疗消化系统疾病的药物,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )| A. | 所有原子可能共平面 | |
| B. | 核磁共振氢谱中有7个峰 | |
| C. | 能发生加聚反应生成高分子化合物 | |
| D. | 1 mol该物质最多能与含4molNaOH的烧碱溶液反应 |