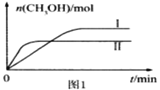
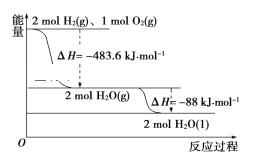
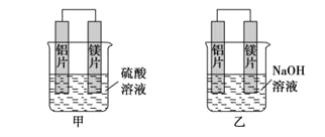
题目内容
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应
H2S(g)+3/2 O2(g)=SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)=3/2 S2(g)+2H2O(g) △H2
H2S(g)+1/2O2(g)=S(g)+H2O(g) △H3
2S(g)=S2(g) △H4
则△H4正确表达式为( )
A. △H4=2/3(△H1+△H2-3△H3) B. △H4=2/3(3△H3-△H1-△H2)
C. △H4=3/2(△H1+△H2+3△H3) D. △H4=3/2(△H1-△H2-3△H3)
【答案】A
【解析】
用盖斯定律进行有关反应热的计算
根据目标方程式2S(g)=S2(g),先把方程式3反写,化学计量数全都乘以2;然后把方程2化学计量数全都乘以![]() ;再把方程1化学计量数全都乘以
;再把方程1化学计量数全都乘以![]() ;最后三者相加;即可以得到△H4=-△H3×2+△H2×
;最后三者相加;即可以得到△H4=-△H3×2+△H2×![]() +△H1×
+△H1×![]() =
=![]() (△H1+△H2-3△H3),答案选A。
(△H1+△H2-3△H3),答案选A。

 培优口算题卡系列答案
培优口算题卡系列答案【题目】溴主要以Br- 形式存在于海水(呈弱碱性)中,利用空气吹出法从海水中提溴,工艺流程示意如下。
![]()
资料:常温下溴呈液态,深红棕色,易挥发。
(1)酸化:将海水酸化的主要目的是避免_______(写离子反应方程式)。
(2)脱氯:除去含溴蒸气中残留的Cl2
①具有脱氯作用的离子是_______。
②溶液失去脱氯作用后,补加FeBr2或加入_______,脱氯作用恢复。
(3)富集、制取Br2:
用Na2CO3溶液吸收溴,Br2歧化为BrO3- 和Br-。再用H2SO4酸化歧化后的溶液得到Br2,其离子反应方程式为_______。
(4)探究(3)中所用H2SO4浓度对Br2生成的影响,实验如下:
序号 | A | B | C |
试剂组成 | 1 mol/L NaBr 20% H2SO4 | 1 mol/L NaBr 98% H2SO4 | 将B中反应后溶液用水稀释 |
实验现象 | 无明显现象 | 溶液呈棕红色,放热 | 溶液颜色变得很浅 |
①B中溶液呈棕红色说明产生了_______。
②分析C中溶液颜色变浅的原因,甲同学认为是发生了化学反应所致;乙同学认为是用水稀释所致。若认为甲同学的分析合理,请用具体的反应说明理由;若认为乙同学的分析合理,进一步设计实验方案说明。理由或方案:_______。
③酸化歧化后的溶液宜选用的酸是______(填“稀硫酸”或“浓硫酸”)。