题目内容
【题目】为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量。
(1)用CH4催化还原煤燃烧产生的氮氧化物,可以消除污染。
已知:CH4(g) + 2NO2(g)=N2(g) +CO2(g) + 2H2O(g) △H=-867.0 kJ/mol
NO2(g)=![]() N2O4(g) △H=-28.5 kJ/mol
N2O4(g) △H=-28.5 kJ/mol
写出CH4催化还原N2O4(g)生成CO2、N2和H2O(g)的热化学方程式 。
(2)一定条件下,将NO2与SO2以体积比1∶2置于恒温恒容的密闭容器中,发生NO2(g)+SO2(g)![]() SO3(g)+NO(g),测得反应达到平衡时NO2与SO2体积比为1∶5,则平衡常数K= (填数值)。
SO3(g)+NO(g),测得反应达到平衡时NO2与SO2体积比为1∶5,则平衡常数K= (填数值)。
(3)如图1是一种用NH3、O2脱除烟气中NO的原理,该原理中NO最终转化为H2O和 (填化学式),当消耗1mol NH3和0.5molO2时,除去的NO在标准状况下的体积为 L。
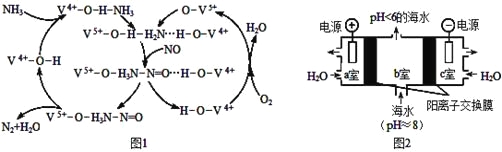
(4)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。有人利用图2所示装置(均为惰性电极)从海水中提取CO2(海水中无机碳95 % 以HCO3-存在),有利于减少环境中温室气体含量。
①a室的电极反应式为 。
②b室中提取CO2的反应的离子方程式为 。
③b室排出的海水(pH<6)不可直接排回大海,需用该装置中产生的物质对b室排出的海水进行处理,合格后才能排回大海。处理的方法是 。
【答案】(14分)
(1)CH4(g) +N2O4(g)=N2(g) +CO2(g) + 2H2O(g) △H=-810.0 kJ/mol;
(2)1.8;
(3)N2;11.2;
(4)①2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O;
②H++HCO3-=H2O + CO2↑;
③用c室排出的碱性溶液将从b室排出的酸性海水调节至接近 正常海水的pH;
【解析】试题分析:(1)已知:Ⅰ、CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol,
Ⅱ、2NO2(g)![]() N2O4(g)△H2=-57kJ/mol,
N2O4(g)△H2=-57kJ/mol,
根据盖斯定律,Ⅰ-Ⅱ得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),故△H=-867kJ/mol-(-57kJ/mol)=-810kJ/mol,
即CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),△H=-810kJ/mol,
故答案为:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)△H=-810kJ/mol;
(2) NO2(g)+SO2(g)![]() SO3(g)+NO(g),
SO3(g)+NO(g),
起始量 a 2a 0 0
变化量 x x x x
平衡量a-x 2a-x x x
由题意可知: ![]() =
=![]() ,解之得:x=
,解之得:x=![]() a,所以K=
a,所以K=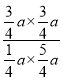 =1.8,故答案为:1.8;
=1.8,故答案为:1.8;
(3)由图1可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水,所以NO最终转化为N2和H2O;氧气、一氧化氮和氨气反应生成氮气和水,反应中氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量,1mol NH3转化为N2失去3mol电子,0.5mol O2得到2mol电子,则NO转化为N2得到的电子为1mol,所以NO的物质的量为0.5mol,其体积为11.2L,故答案为:N2;11.2;
(4)①a室为阳极,发生氧化反应,电极方程式为2H2O-4e-=4H++O2↑,故答案为:2H2O-4e-=4H++O2↑;②氢离子通过阳离子交换膜进入b室,发生反应:H++HCO3-=CO2↑+H2O,故答案为:H++HCO3-=CO2↑+H2O;③c室发生2H2O+2e-=2OH-+H2↑,可用c室排出的碱液将从b室排出的酸性海水调节至装置入口海水的pH,以达到排放标准,故答案为:用c室排出的碱液将从b室排出的酸性海水调节至装置入口海水的pH。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案