题目内容
【题目】室温下,用0.1 mol/L HCl溶液滴定10 mL 0.1 mol/L Na2CO3溶液,滴定曲线如图所示。下列说法正确的是( )
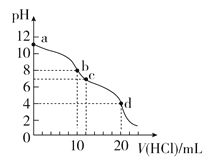
A. 水电离程度由大到小的顺序为:a>b>c>d
B. a点时:c(Na+)>c(CO![]() )>c(HCO)>c(OH-)
)>c(HCO)>c(OH-)
C. b点时:3c(Na+)=2c(CO![]() )+2c(HCO)+2c(H2CO3)
)+2c(HCO)+2c(H2CO3)
D. d点时:c(H+)>c(HCO)=c(CO![]() )
)
【答案】A
【解析】A.碳酸钠溶液中的氢氧根离子是水电离的,溶液pH越大,水的电离程度越大,则abc三点水的电离程度大小为:a>b>c,d点盐酸过量,溶液显示酸性,氢离子抑制了水的电离,则d点水的电离程度最小,则水的电离程度大小为:a>b>c>d,故A正确;B.a点时为碳酸钠溶液,碳酸根离子部分水解,溶液显碱性,则:c(Na+)>c(CO32-),由于氢氧根离子来自水的电离和碳酸根离子的水解,则c(OH-)>c(HCO3-),溶液中离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-),故B错误;C.b点时加入10mL相同浓度的盐酸,二者恰好反应生成碳酸氢钠,根据碳酸氢钠溶液中的物料守恒可得:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),故C错误;D.d点时加入20mL盐酸,二者恰好反应生成氯化钠和碳酸,碳酸为二元弱酸,以第一步电离为主,则c(HCO3-)>c(CO32-),溶液中离子浓度大小为:c(H+)>c(HCO3-)>c(CO32-),故D错误;故选A。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。
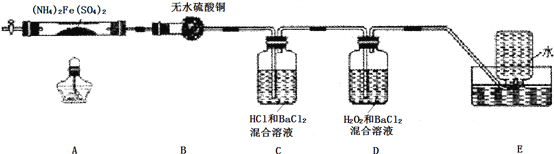
(1)B装置的作用是___________________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有_______气体产生,写出D中发生反应的离子方程式_______。若去掉C,是否能得出同样结论并解释其原因______________。
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请完成表中内容。(试剂,仪器和用品自选)
实验步骤 | 预期现象 | 结论 |
取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解;___________ | ____________________ | 固体残留物仅为Fe2O3 |
(4)若E中收集到的气体只有N2,其物质的量为x mol,固体残留物Fe2O3,的物质的量为y mol,D中沉淀物质的量为z mol,根据氧化还原反应的基本规律,x、y和z应满足的关系为______________。
(5)结合上述实验现象和相关数据的分析,完成硫酸亚铁铵[(NH4)2Fe(SO4)2]在500℃时隔绝空气加热完全分解的化学方程式__________________。
(6)用氧化还原滴定法测定制备得到的TiO2试样中的TiO2的质量分数:在一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作为指示剂,用硫酸铁铵[NH4Fe(SO4)2]标准溶液滴定Ti3+至全部生成Ti4+。
①TiCl4水解生成TiO2·xH2O的化学方程式为_______________。
②滴定终点的现象是_______________。
③滴定分析时,称取TiO2试样0.2 g,消耗0.1 mol·L-1NH4Fe(SO4)2标准溶液20mL,则TiO2的质量分数为_______________。
④若在滴定终点读取滴定管刻度时,俯视标准溶液的液面,使其测定结果_______(填“偏大”“偏小”或“无影响”)。