题目内容
9.火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2═Cu2S+2FeS+SO2.下列说法正确的是( )| A. | CuFeS2仅作还原剂,硫元素被氧化 | |
| B. | 每生成1molSO2,反应共转移6mol电子 | |
| C. | CuFeS2中被氧化的原子和被还原的原子数目之比为2:1 | |
| D. | 该反应中有两种物质作还原剂 |
分析 2CuFeS2+O2=Cu2S+2FeS+SO2,Cu、O元素的化合价降低,S元素的化合价升高,该反应中转移6e-,以此来解答.
解答 解:A.CuFeS2中,Cu元素的化合价降低,S元素的化合价升高,既作还原剂也作氧化剂,硫元素被氧化,故A错误;
B.反应中S元素的化合价由-2升高到+4,所以每生成1molSO2,反应共转移1×(4+2)=6mol电子,故B正确;
C.根据方程式,每生成1molCu2S,由反应可知,生成1molSO2,则有1mol硫被氧化,2moL铜被还原,所以CuFeS2中被氧化的原子和被还原的原子数目之比为1:2,故C错误;
D.2CuFeS2+O2=Cu2S+2FeS+SO2,Cu、O元素的化合价降低,S元素的化合价升高,所以只有CuFeS2作还原剂,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中转移电子及基本概念的考查,注意元素化合价的判断,题目难度不大.

练习册系列答案
相关题目
19.已知:xA(g)+yB(g) zC(g);△H=a.将x mol A和y mol B混合在密闭容器中,在不同温度(T1>T2)及压强(P1>P2)下,C的物质的量n(C)与反应时间(t)的关系如图所示.下列判断正确的是( )
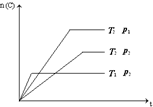

| A. | x+y=z; a>0 | B. | x+y>z; a<0 | C. | x+y<z; a<0 | D. | x+y<z; a>0 |
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2 L H2O中含有的分子数为0.5 NA | |
| B. | 把40 g NaOH固体溶于1 L水中,所得溶液中NaOH的物质的量浓度为1 mol•L-1 | |
| C. | 常温常压下,16g O3中含有NA个氧原子 | |
| D. | 1 mol钠原子中含有的电子数为NA |
17.下列关于胶体的叙述中,正确的是( )
| A. | 胶体是一种分散质直径小于10-10 m的分散系 | |
| B. | 胶体一定是粘稠的液体 | |
| C. | CuSO4溶液是一种胶体 | |
| D. | 可用丁达尔效应区别溶液和胶体 |
4.下列各项中,用括号里的物质除去杂质,其中错误的是( )
| A. | CO中混有CO2(NaOH溶液) | B. | NaOH中混有Na2CO3(盐酸) | ||
| C. | Cl2中混有HCl(饱和食盐水) | D. | KNO3溶液中混有KCl(AgNO3溶液) |
1.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.01NA | |
| C. | 常温常压下,NA个CO2分子占有的体积为22.4L | |
| D. | 1升物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 数目为NA |
18.下列哪组混合后,振荡,静置出现上层液体为无色,下层为橙色的是( )
| A. | 溴水、酒精 | B. | 碘水、汽油 | C. | 溴水、四氯化碳 | D. | 碘水、四氯化碳 |
19.把7.4g Na2CO3•10H2O和NaHCO3组成的混合物完全溶解于水配成100mL溶液,其中c(Na+)=0.6mol/L.向溶液中加入足量的盐酸充分反应,将溶液蒸干后,所得固体质量是( )
| A. | 2.12g | B. | 3.51g | C. | 4.22g | D. | 5.28g |