题目内容
【题目】二氧化锰在生活和化学实验中有广泛应用。海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:

(1)步骤Ⅰ中,试剂甲必须具有的性质是________(填序号)。
A.碱性 B.稳定性 C.氧化性 D.还原性
(2)用惰性材料作电极,电解硫酸锰溶液制二氧化锰,写出阳极反应式:_____________________。步骤Ⅲ中,以KClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的KClO3溶液200 mL,该反应的离子方程式为____________________________________________。
(3)用100 mL 12.0 mol·L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气在标准状况下体积范围为________________。工业上可以用实验室制氯气的残余物质溶液吸收氯气,获得Mn2O3,Mn2O3广泛应用于电子工业、印染工业等领域。请写出该化学反应的离子方程式:__________________。
(4)二氧化锰是实验室制取氧气的催化剂。下列是某同学设计实验探究双氧水分解实验方案;
实验 | 20.0 mL双氧水溶液浓度 | 粉状MnO2 | 温度 | 待测数据 |
Ⅰ | 5% | 2.0 g | 20℃ | |
Ⅱ | 5% | 1.0 g | 20℃ | |
Ⅲ | 10% | 1.0 g | 20℃ | |
Ⅳ | ω | 2.0 g | 30℃ |
①实验Ⅱ和Ⅲ的结论是____________________________________________________。
②利用实验Ⅰ和Ⅳ探究温度对化学反应速率的影响,w=________。本实验待测数据是______。
【答案】DMn2+-2e-+2H2O===MnO2↓+4H+2ClO![]() +5Mn2++4H2O===5MnO2+Cl2↑+8H+V(Cl2)<6720 mL2Mn2++Cl2+3H2O===Mn2O3+6H++2Cl-其他条件不同,反应物浓度越大,反应速率越快5%收集等体积氧气所需要的时间
+5Mn2++4H2O===5MnO2+Cl2↑+8H+V(Cl2)<6720 mL2Mn2++Cl2+3H2O===Mn2O3+6H++2Cl-其他条件不同,反应物浓度越大,反应速率越快5%收集等体积氧气所需要的时间
【解析】
(1)锰结核矿与试剂甲反应后生成+2价锰离子,锰元素的化合价降低,被还原,则试剂甲具有还原性,故答案为:D;
(2)电解硫酸锰溶液时,阳极发生氧化反应,+2价的锰离子被氧化成二氧化锰,电极反应式为:Mn2+-2e-+2H2O===MnO2↓+4H+;生成0.050 mol二氧化锰时,失去电子的物质的量:0.050 mol×2=0.100 mol;设还原产物中氯元素化合价为+x,n(kClO3)=0.2 L×0.1 mol·L-1=0.02 mol。由电子守恒知,0.02 mol×(5-x)=0.100 mol,x=0,氯酸钾被还原后产物为氯气,则反应的离子反应方程式为:2ClO![]() +5Mn2++4H2O===5MnO2+Cl2↑+8H+;故答案为:Mn2+-2e-+2H2O===MnO2↓+4H+; 2ClO
+5Mn2++4H2O===5MnO2+Cl2↑+8H+;故答案为:Mn2+-2e-+2H2O===MnO2↓+4H+; 2ClO![]() +5Mn2++4H2O===5MnO2+Cl2↑+8H+; (3)由于浓盐酸的挥发、浓盐酸变成稀盐酸时不能与二氧化锰发生反应,生成的氯气体积小于理论值,浓盐酸所含HCl的物质的量为:12mol/L×0.1L=1.2mol/L,由反应方程式:MnO2+4HCl
+5Mn2++4H2O===5MnO2+Cl2↑+8H+; (3)由于浓盐酸的挥发、浓盐酸变成稀盐酸时不能与二氧化锰发生反应,生成的氯气体积小于理论值,浓盐酸所含HCl的物质的量为:12mol/L×0.1L=1.2mol/L,由反应方程式:MnO2+4HCl![]() MnCl2+Cl2↑+2H2O可得产生氯气的物质的量理论值为:1.2mol÷4=0.3mol,其体积为:0.3mol/L×22.4L/mol=6.72L;实验室制氯气的残余物质溶液中含有Mn2+,可被氯气氧化为Mn2O3,反应的离子方程式为:2Mn2++Cl2+3H2O===Mn2O3+6H++2Cl-,故答案为:V(Cl2)<6720 mL;2Mn2++Cl2+3H2O===Mn2O3+6H++2Cl-;
MnCl2+Cl2↑+2H2O可得产生氯气的物质的量理论值为:1.2mol÷4=0.3mol,其体积为:0.3mol/L×22.4L/mol=6.72L;实验室制氯气的残余物质溶液中含有Mn2+,可被氯气氧化为Mn2O3,反应的离子方程式为:2Mn2++Cl2+3H2O===Mn2O3+6H++2Cl-,故答案为:V(Cl2)<6720 mL;2Mn2++Cl2+3H2O===Mn2O3+6H++2Cl-;
(4)①实验Ⅱ和Ⅲ的双氧水浓度不同,其它条件均相同,则通过实验对比来探究浓度对化学反应速率的影响,故答案为:其他条件不同,反应物浓度越大,反应速率越快;
②实验Ⅰ和Ⅳ的对比实验是探究温度对化学反应速率的影响的,则其它条件须控制相同,实验Ⅰ中双氧水的浓度为5%,故w=5%;比较在不同条件下双氧水的分解速率,可通过测定收集一定体积气体所需要的时间或测定在相同时间内产生气体的体积来比较不同条件下反应的快慢,故答案为:5%、收集等体积氧气所需要的时间;

 阅读快车系列答案
阅读快车系列答案【题目】化石能源的脱硫处理是环保热点问题。
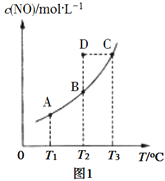
用臭氧处理燃煤烟气脱硫的主要反应如下:![]()
![]() ,向1L反应装置充入
,向1L反应装置充入![]() 和
和![]() ,经过相同反应时间t后剩余
,经过相同反应时间t后剩余![]() 的物质的量与温度关系如图所示:
的物质的量与温度关系如图所示:

已知臭氧会转化成氧气:![]() ,在上述反应条件下臭氧分解率与温度关系如下:
,在上述反应条件下臭氧分解率与温度关系如下:
温度 | 50 | 100 | 150 | 200 | 250 | 300 |
| 0 | 0 | 0 | 4 | 20 | 81 |
![]() 关于脱硫的主要反应,下列说法错误的是______________。
关于脱硫的主要反应,下列说法错误的是______________。
![]() 时,缩小反应装置的体积可以提高相同时间t内
时,缩小反应装置的体积可以提高相同时间t内![]() 的转化率
的转化率
![]() 点该反应处于平衡状态
点该反应处于平衡状态
![]() 随温度的升高,正反应速率变大,逆反应速率减小
随温度的升高,正反应速率变大,逆反应速率减小
![]() 以后随着温度升高,
以后随着温度升高,![]() 的物质的量增多的原因可能是______________________。
的物质的量增多的原因可能是______________________。
![]() 已知
已知![]() 时
时![]() 的平衡常数
的平衡常数![]() ,求该温度下反应
,求该温度下反应![]() 的平衡常数
的平衡常数![]() __________。
__________。
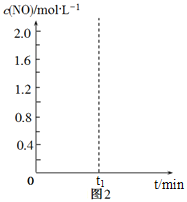
![]() 其他条件不变,经过相同反应时间
其他条件不变,经过相同反应时间![]() ,在图中画出剩余
,在图中画出剩余![]() 的物质的量在
的物质的量在![]() 点温度范围内的关系趋势图____________。
点温度范围内的关系趋势图____________。
![]() 烟气脱硫后续还需用碱液吸收
烟气脱硫后续还需用碱液吸收![]() 形成
形成![]() ,溶液pH为
,溶液pH为![]() 之间时
之间时![]() 在电解池阴极上被还原成连二硫酸根
在电解池阴极上被还原成连二硫酸根![]() ,写出该电极反应式:___________________________。
,写出该电极反应式:___________________________。