��Ŀ����
��8�֣��ִ���п�ķ����ɷ�Ϊ��ʪ�������࣬������������п�ĸ���Ʒ�����ڸ߶��Խ������Իش������������.
��1������п�ǽ���п����Ҫ��ZnS��ͨ����ѡ������ʹ��ת��Ϊ����п���ٰ�����п�ͽ�̿��ϣ��ڹķ�¯�м�����1373-1573K��ʹп���������
��Ҫ��ӦΪ��2ZnS +3O2![]() 2ZnO+2SO2 ���ķ�¯�У�2C +O2
2ZnO+2SO2 ���ķ�¯�У�2C +O2![]() 2CO
2CO
�ķ�¯�У�ZnO+CO![]() Zn+ CO2
Zn+ CO2
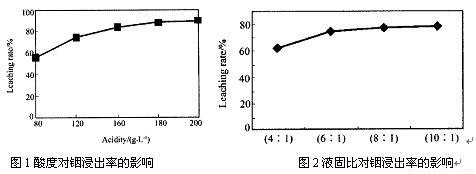
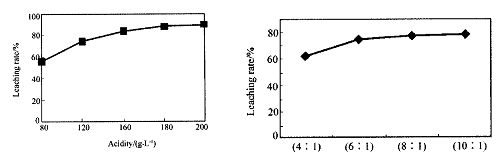
�ӻ���п�����IJ����к����ֽ������ʼ�In2O3������������ȡ����ij�о�������Щ�о��������¡�ʵ�����漰����ȣ�ÿ����Һ�к�����������������Ľ���������ͼ1��������Һ������������������ͼ2��
�ٵ����Ϊ196ʱ�������ʵ���Ũ��Ϊ �� ��
�ڴӽ�Լԭ�Ϻͽ����ʿ��ǣ����˵���Ⱥ�Һ�̱ȷֱ�Ϊ�� �� �� �� ��
��2��ʪ����п����Ҫ��������Ϊ��
�������ȡ����Ҫ��Ӧ�����ӷ���ʽΪ�� �� ��
�ڴӱ��������ͳ������ԭ�ϽǶȣ���δ������������� �� ��
�۳�ȥ�����Һ�е���������H2O2�������ٵ���pHʹ֮�γ�Fe(OH)3������д��H2O2����Fe2+�����ӷ���ʽ �� ��
�������Һ������Cd2+,Ϊ�˷�ֹ����Ⱦ�������ӣ������������ʵIJ��죬��������������Һ���룬��֪Zn(OH)2����������һ��Ҳ�������ԣ���д����������ӷ���ʽ �� �� �� ��
��1����2mol/L �� 180 6��1
��2����ZnO +2H+= Zn2+ +H2O
�ڽ��̵����������������������
��2Fe2+ +H2O2 +2H+ = 2Fe3++2H2O
��Cd2+ + 2OH��=Cd(OH)2����Zn2++4OH��=ZnO22��+2H2O[��Zn2++4OH�� = Zn(OH)42��]��
��ÿ��1�֣���8�֣�
����:

 ǧ�������������ĩ�����Ծ�����ϵ�д�
ǧ�������������ĩ�����Ծ�����ϵ�д�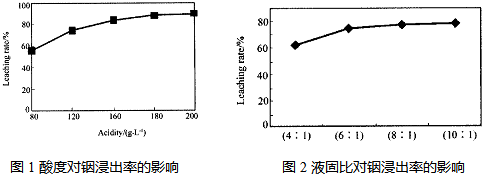



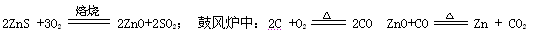

 2ZnO+2SO2
���ķ�¯�У�2C +O2
2ZnO+2SO2
���ķ�¯�У�2C +O2 2CO
2CO