题目内容
(2011?临川区模拟)现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选.焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来.主要反应为:
2ZnS+3O2
2ZnO+2SO2; 鼓风炉中:2C+O2
2CO ZnO+CO
Zn+CO2
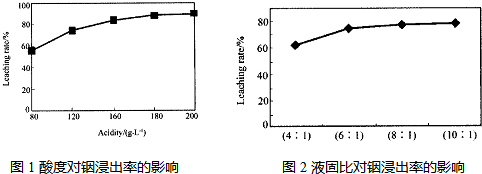
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下.实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如图1;硫酸溶液的体积与固体的体积比如图2
①当酸度为196时,其物质的量浓度为
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:
(2)湿法炼锌的主要工艺流程为:

①从保护环境和充分利用原料角度,如何处理或利用烟气
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选.焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来.主要反应为:
2ZnS+3O2
| ||
| ||
| ||
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下.实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如图1;硫酸溶液的体积与固体的体积比如图2

①当酸度为196时,其物质的量浓度为
2mol?L-1
2mol?L-1
.②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:
180
180
,6:1
6:1
.(2)湿法炼锌的主要工艺流程为:

①从保护环境和充分利用原料角度,如何处理或利用烟气
将烟道气净化,用于生产硫酸等
将烟道气净化,用于生产硫酸等
.②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
.③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式
Cd2++2OH-=Cd(OH)2↓;Zn2++4OH-=ZnO22-+2H2O[或Zn2++4OH-=Zn(OH)42-]
Cd2++2OH-=Cd(OH)2↓;Zn2++4OH-=ZnO22-+2H2O[或Zn2++4OH-=Zn(OH)42-]
.分析:(1)①根据酸度的定义计算,酸度为196时,说明1L溶液中硫酸的质量为196g,即硫酸为2mol,故浓度为2mol/L;
②根据图象可以看出,当酸度为180或液固比为6:1时,浸出率变化不大;
(2)①闪锌矿主要含ZnS,在焙烧时生成二氧化硫气体,可用于生产硫酸;
②H2O2具有氧化性,在酸性条件下将具有还原性的Fe2+离子氧化成Fe3+离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
③Zn(OH)2和氢氧化铝一样也具有两性,既可与酸反应生成盐和水,又能和碱反应生成盐和水,可根据氢氧化铝的反应来书写.
②根据图象可以看出,当酸度为180或液固比为6:1时,浸出率变化不大;
(2)①闪锌矿主要含ZnS,在焙烧时生成二氧化硫气体,可用于生产硫酸;
②H2O2具有氧化性,在酸性条件下将具有还原性的Fe2+离子氧化成Fe3+离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
③Zn(OH)2和氢氧化铝一样也具有两性,既可与酸反应生成盐和水,又能和碱反应生成盐和水,可根据氢氧化铝的反应来书写.
解答:解:(1)①酸度为196时,说明1L溶液中硫酸的质量为196g,硫酸的物质的量为
=2mol,浓度为2mol/L,故答案为:2mol?L-1;
②由图象可以看出,当酸度为180或液固比为6:1时,浸出率变化不大,从节约原料和浸出率考虑,适宜的酸度和液固比分别为:180; 6:1,故答案为:180; 6:1;
(2)①闪锌矿主要含ZnS,在焙烧时生成二氧化硫气体,如随意排放会污染环境,可用于生产硫酸,故答案为:将烟道气净化,用于生产硫酸等;
②H2O2具有氧化性,在酸性条件下将具有还原性的Fe2+离子氧化成Fe3+离子,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
③根据Zn(OH)2和氢氧化铝一样也具有两性,既可与酸反应生成盐和水,又能和碱反应生成盐和水,酸浸出液还含有Cd2+,为了防止镉污染并回收镉,可加过量的碱溶液,反应分别为:Cd2++2OH-=Cd(OH)2↓;Zn2++4OH-=ZnO22-+2H2O[或Zn2++4OH-=Zn(OH)42-].
故答案为:Cd2++2OH-=Cd(OH)2↓;Zn2++4OH-=ZnO22-+2H2O[或Zn2++4OH-=Zn(OH)42-]
| 196g |
| 98g/mol |
②由图象可以看出,当酸度为180或液固比为6:1时,浸出率变化不大,从节约原料和浸出率考虑,适宜的酸度和液固比分别为:180; 6:1,故答案为:180; 6:1;
(2)①闪锌矿主要含ZnS,在焙烧时生成二氧化硫气体,如随意排放会污染环境,可用于生产硫酸,故答案为:将烟道气净化,用于生产硫酸等;
②H2O2具有氧化性,在酸性条件下将具有还原性的Fe2+离子氧化成Fe3+离子,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
③根据Zn(OH)2和氢氧化铝一样也具有两性,既可与酸反应生成盐和水,又能和碱反应生成盐和水,酸浸出液还含有Cd2+,为了防止镉污染并回收镉,可加过量的碱溶液,反应分别为:Cd2++2OH-=Cd(OH)2↓;Zn2++4OH-=ZnO22-+2H2O[或Zn2++4OH-=Zn(OH)42-].
故答案为:Cd2++2OH-=Cd(OH)2↓;Zn2++4OH-=ZnO22-+2H2O[或Zn2++4OH-=Zn(OH)42-]
点评:本题以信息题目的形式考查金属冶炼的一般原理,做题时注意题中给予的关键信息,如闪锌矿的组成,酸度等问题,本题较为综合,具有一定难度.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目

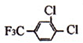 +
+
 +HCl
+HCl A发生缩聚反应
A发生缩聚反应 +nH2O
+nH2O 的含有三氟甲基(F3C一)和苯环的同分异构体共有
的含有三氟甲基(F3C一)和苯环的同分异构体共有