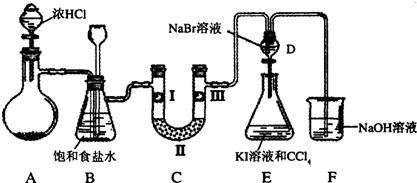
题目内容
13.某兴趣小组模拟工业制造印刷电路板,将FeCl3溶液敷在绝缘板的铜箔上,发生反应:2FeCl3+Cu═2FeCl2+CuCl2.小组同学从反应后的溶液中回收铜,并重新获得FeCl3溶液,按如图流程在实验室中进行实验.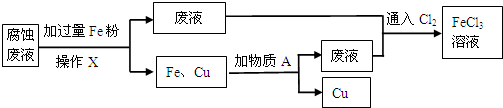
(1)操作X的名称是过滤.
(2)加入的物质A是盐酸或HCl.
(3)写出废液通入Cl2生成FeCl3的离子方程式2Fe2++Cl2=2Fe3++2Cl-.
(4)Cu在Cl2中燃烧产生棕黄色的烟,生成CuCl2(填化学式),在该反应中Cu作为还原剂(填“氧化剂”或“还原剂”).
分析 (1)FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2,由流程可知,加Fe与氯化铁、氯化铜反应,铁粉过量,则通过过滤分离溶液中的不溶物;
(2)废液为FeCl2、HCl,滤渣中含Fe、Cu,加过量试剂A为盐酸,过滤得到金属Cu;
(3)氯气具有强氧化性,能将亚铁离子氧化为铁离子;
(4)Cu在Cl2中燃烧产生棕黄烟,氯气具有强氧化性,能将变价金属氧化成高价,在反应中有元素化合价升高的反应物为还原剂.
解答 解:(1)氯化铁与铜反应生成氯化亚铁与氯化铁,反应方程式为:2FeCl3+Cu═2FeCl2+CuCl2,固液分离常采用过滤的方法,滤液为FeCl2,滤渣中含Fe、Cu,
故答案为:过滤;
(2)由流程可知,加Fe与氯化铁、氯化铜反应,铁粉过量,则废液为FeCl2、HCl,滤渣中含Fe、Cu,加过量试剂A为盐酸,盐酸和铁反应生成氯化亚铁和氢气,铜不反应,过滤得到金属Cu,回收铜,所以A为盐酸或HCl,
故答案为:盐酸或HCl;
(3)废液为FeCl2,HCl,通入氯气,将铁的化合物全部转化为FeCl3溶液,能避免引人杂质,氯气具有强氧化性,能将亚铁离子氧化为铁离子反应为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)Cu在Cl2中燃烧产生棕黄烟,氯气具有强氧化性,铜和氯气反应生成氯化铜,在该反应中铜从0→+2,Cu作为还原剂,
故答案为:棕黄;CuCl2;还原剂.
点评 本题考查混合物分离提纯的实验方案设计,为高频考点,把握物质的性质、流程中的反应及混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
3.下列物质中,能产生丁达尔现象的是( )
| A. | 氯酸钾溶液 | B. | 雾 | C. | 石灰乳 | D. | 油水混合物 |
1.用NA表示阿伏加德罗常数值,下列叙述正确的是( )
| A. | 28gCO中含有的分子数为NA | |
| B. | 22.4L空气含有NA个单质分子 | |
| C. | 1mol/L的NaCl溶液含有NA个Na+ | |
| D. | 1mol Na2O2固体中含有的离子总数为4NA |
8.下列说法不正确的是( )
| A. | 用SO2漂白食品 | B. | 用硅制作太阳能电池 | ||
| C. | 工业上用氮气和氢气合成氨 | D. | 漂白粉可用于杀菌消毒 |
5.下列说法中正确的是(NA为阿伏加德罗常数)( )
| A. | 48gO3气体含有NA个O3分子 | |
| B. | 7.8gNa2O2含有0.2NA个阴离子 | |
| C. | 27gAl含有电子的总数为3NA个 | |
| D. | 标准状况下,22.4LH2O中含有NA个氧原子 |
2.常温下,下列物质属于电解质但不能导电的是( )
| A. | 蔗糖溶液 | B. | 氯化钠溶液 | C. | 氢氧化钠 | D. | 稀硫酸 |
16.下列有关化学用语表示正确的是( )
| A. | 18O2-结构示意图: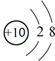 | |
| B. | Na2O2的电子式: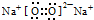 | |
| C. | HCO3- 的水解方程式HCO3-+H2O?H2CO3+OH- | |
| D. | HI的电离方程式 HI?H++I- |