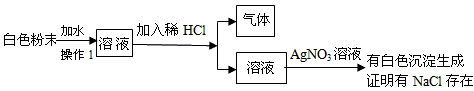
题目内容
现有一包白色粉末,其中可能含有CaCO3、Na2CO3、Na2SO4、NaCl、CuSO4,进行如下实验:①溶于水得无色溶液;②向溶液中加入BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失,据上述实验现象推断:一定不存在___________,一定存在_____________,可能存在_________,对于可能存在的物质应如何近一步检验?写出简要的步骤和有关的离子方程式: 。
CaCO3、CuSO4、Na2SO4;Na2CO3;NaCl。取无色溶液少量放于试管中,滴加足量的稀HNO3,待气泡放尽后,滴加AgNO3 试剂,看是否产生白色沉淀。若有,则含有NaCl,反之则无。CO32-+2H+=CO2↑+H2O;Ag++Cl- =AgCl↓。
解析:
有题意中的①溶于水得无色溶液知该包白色粉末中无呈蓝色的CuSO4、无白色沉淀CaCO3,又有②向溶液中加入BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失推知该包白色粉末中无Na2SO4,一定有Na2CO3,NaCl不能确定,若要进一步确定NaCl,则用AgNO3、稀硝酸法检验。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
已知Na2SO3在空气中易被氧化为Na2SO4,现有一包包装破损的白色Na2SO3固体粉末,为了检验其是否变 质,正确的方法是
质,正确的方法是
| A.取少量样品于试管中,滴入稀盐酸,无沉淀,再滴入BaCl2溶液,若有白色沉淀产生,则说明已变质。 |
| B.取少量样品于试管中,滴入稀硝酸,再滴入BaCl2溶液,若有白色沉淀产生,则说明已变质。 |
| C.取少量样品于试管中,滴入稀硫酸,再滴入BaCl2溶液,若有白色沉淀产生,则说明已变质。 |
| D.取少量样品于试管中,滴入稀盐酸,若产生使品红溶液褪色的气体,则说明已变质 |