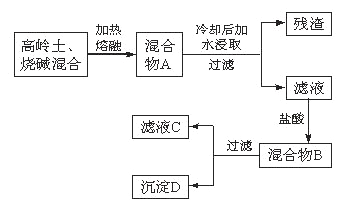
题目内容
【题目】工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
(1)不同温度下的平衡转化率与压强的关系如图所示。
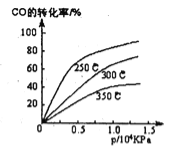
①该反应△H 0,△S 0(填“>”或“<”),则该反 自发进行(填“一定能”、“一定不能”、“不一定”)实际生产条件控制在250℃、l.3×l04kPa左右,选择此压强的理由是 。
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.l mol·L -1。
①该反应的平衡常数K= :
②在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是 (填序号)。
A.氢气的浓度减少
B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加
D.重新平衡时n(H2)/n(CH3OH)增大
③若保持同一反应温度将起始物质改为a mol CO、b mol H2、c mol CH30H,欲使平衡混合物中各组成与原平衡相同,则a、b应满足的关系为 ,且欲使开始时该反应向逆反应方向进行,c的取值范围是 。
【答案】(1)①< <) 不一定 ②该压强下,CO转化率已较高(90%左右),再增大压强CO转化率提高不大,且生产成本增加 (2)① 6.25 ② b c ③ b = 2+2a 1.8<c ≤2
【解析】
试题分析:(1)①由图可知:在压强不变的情况下:升高温度,CO的转化率降低,说明升高温度,化学平衡向逆反应方向移动。逆反应方向是吸热反应。正反应是放热反应。所以ΔH<0.在温度不变时,增大压强,CO的转化率增大。说明增大压强化学平衡向正反应方向移动。ΔS<0..由于正反应是一个体系混乱程度减小的放热反应,所以无法确定该反应能否自发进行。②选择此压强的理由是在该压强下,CO转化率已较高(90%左右),再增大压强,CO转化率虽然提高但提高不大,且生产成本增加的多,效益反而降低。(2)①反应开始时CO H2CH3OH的浓度分别是1mo/L 3mol/L 0mol/L,在反应过程中转化浓度分别是0.9mol/L 1.8mol/L 0.9mol/L.所以它们的平衡浓度分别是0.1mol/L 1.2mol/L 0.9mol/L所以达到化学平衡时平衡常数是K=(0.9)÷{0.1×(1.2)2}= 6.25 ②将容器体积压缩到原来的1/2,化学平衡向正反应方向移动。与原平衡相比,正反应速率加快,逆反应速率也加快;各物质的浓度都增大,甲醇的物质的量也增加增加 ; D.重新平衡时n(H2)/n(CH3OH)减小。正确选项为:bc.③若保持同一反应温度将起始物质改为a mol CO、b mol H2、c mol CH30H,欲使平衡混合物中各组成与原平衡相同,则a、b应满足的关系为b=2+2a.假如物质时由CH3OH转化生成,则开始时n(CH3OH)=2mol,因为平衡时n(CH3OH)=0.9mol/L×2L=1.8mol.所以欲使开始时该反应向逆反应方向进行,c的取值范围是 1.8<c ≤2

 智慧小复习系列答案
智慧小复习系列答案【题目】有关键能(破坏1mol共价键吸收的能量)数据如表
化学键 | Si-O | O=O | Si-Si |
键能/kJmol-1 | X | 498.8 | 176 |
晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s)△H=-989.2kJmol-1,则X的值为( )
(已知1molSi中含有2molSi-Si键,1molSiO2中含有4molSi-O键)
A. 460 B. 423.3 C. 832 D. 920